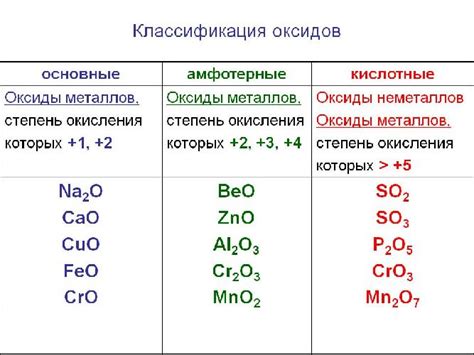
Реакции щелочных металлов с кислотными оксидами являются одним из фундаментальных процессов в химии. Щелочные металлы, такие как натрий, калий и литий, обладают высокой реакционной способностью и способны взаимодействовать с различными веществами. Кислотные оксиды представляют собой неорганические соединения, которые содержат кислород и обладают кислотными свойствами.
Особенностью реакций щелочных металлов с кислотными оксидами является возможность образования солей с кислотными свойствами. В результате таких реакций образуются ионы металла и ионы оксианьона. Процесс взаимодействия между щелочным металлом и кислотным оксидом осуществляется путем обмена ионами.
Примером реакции щелочного металла с кислотным оксидом является реакция натрия с кислородом. При этой реакции образуется натрий оксид (Na2O), который является основанием.
Интересным фактом является то, что многие щелочные металлы могут реагировать с различными кислотными оксидами, образуя разные соединения. Таким образом, реакции щелочных металлов с кислотными оксидами представляют собой важный механизм в химии и имеют широкое применение в различных областях науки и промышленности.
Ознакомление с особенностями и примерами реакций щелочных металлов с кислотными оксидами позволяет понять физические и химические свойства этих соединений, а также использовать их в практических целях. Это важная информация для химиков, исследователей и студентов, изучающих химию.
Реакция натрия с кислотными оксидами

Натрий – один из щелочных металлов, обладающий высокой реакционной способностью. Взаимодействие натрия с кислотными оксидами является одним из примеров спонтанных реакций между металлами и оксидами.
Натрий реагирует с оксидами, образующими кислоты, образуя соль и соответствующую кислоту. Например, при реакции натрия с диоксидом серы SО2 образуется сульфат натрия (Na2SO4) и образующаяся в результате серная кислота.
Реакцию можно описать следующим уравнением:
2Na + SO2 → Na2SO4
Процесс происходит с выделением большого количества тепла и образованием пены, состоящей из серы и натрия.
Также натрий реагирует с другими кислотными оксидами, например с оксидом азота (НО) образуется соответствующая соль – нитрат натрия (NaNO3) и азотная кислота (HNO3).
Влияние калия на кислотные оксиды
Оксиды калия – химические соединения, образованные кислородом и калием. Взаимодействие калия с кислотными оксидами приводит к различным химическим реакциям и образованию новых веществ.
Калий имеет активное металлическое свойство, что позволяет ему быстро реагировать с оксидами. Отдельные оксиды калия, такие как K2O (оксид калия(I)), K2O2 (оксид калия(II)) и K2O4 (оксид калия(IV)), обладают сильной щелочной реакцией.
Воздействие калия на оксид серы (SO3) приводит к образованию серной кислоты – растворимой кислоты, обладающей кислотными свойствами. Серная кислота активно используется в химической промышленности и лабораторной практике.
Также взаимодействие калия с некоторыми кислотными оксидами приводит к образованию пероксидов, таких как K2O2 (оксид калия(II)). Пероксиды являются мощными окислителями и активно использовались в прошлом в качестве ярких загрузок для фейерверков, но из-за их опасности они были заменены более безопасными веществами.
Реактивность лития с кислотными оксидами

Литий, будучи первым щелочным металлом в периодической системе, обладает наибольшей реактивностью среди всех щелочных металлов. Из-за своей высокой активности, литий встречается только в соединениях, а в свободном состоянии практически не встречается в природе.
Для реакции лития с кислотными оксидами характерны следующие особенности:
- Литий реагирует с кислотными оксидами, образуя соли. При этом окислительность оксида должна быть выше, чем окислительность лития.
- Реакция лития с кислотными оксидами протекает с выделением большого количества тепла и образованием воды.
- Реакция происходит в результате обмена ионами между литием и кислотным оксидом. Образовавшаяся соль растворяется в воде и может образовывать кристаллические соединения.
Примером реакции лития с кислотными оксидами может служить реакция с оксидом серы IV (серной ангидридом):
| Вещество | Уравнение реакции |
|---|---|
| Литий (Li) | 2Li + SO2 → Li2SO3 |
В результате этой реакции сульфит лития образует при взаимодействии с водой гидратированный сульфит лития, который может выступать в качестве источника лития в различных приложениях.
Особенности реакции рубидия с кислотными оксидами

Рубидий (Rb) – щелочный металл, который обладает рядом особенностей взаимодействия с кислотными оксидами. При реакции рубидия с кислотными оксидами происходит образование солей и выделение газов.
Взаимодействие рубидия с кислотными оксидами сопровождается образованием рубидиевых солей. Например, рубидий при реакции с оксидом азота (III) образует рубидиевый нитрит, который обладает формулой RbNO2. При этом оксид азота (III) превращается в воду. Также известна реакция рубидия с оксидом серы (IV), при которой образуется рубидиевая сульфатная соль Rb2SO4.
В ходе реакции рубидия с кислотными оксидами также наблюдается выделение газов. Например, при реакции рубидия с углекислым газом (оксид углерода IV) образуется рубидиевый карбонат Rb2CO3 и выделяется углекислый газ (двуокись углерода). Также известна реакция рубидия с оксидом фосфора (V), при которой образуется рубидиевый фосфат Rb3PO4 и выделяется пятиокись фосфора.
Реакции рубидия с кислотными оксидами могут быть применены в промышленности и исследовательских целях. Например, рубидиевые соли могут использоваться в качестве катализаторов в химических реакциях или в процессе производства стекла и керамики. Кроме того, изучение реакций рубидия с кислотными оксидами позволяет более глубоко понять особенности химических свойств этого щелочного металла.
Взаимодействие цезия с кислотными оксидами

Цезий – это щелочной металл, сравнительно редкий в природе, однако широко используется в различных отраслях промышленности и науки. Этот металл характеризуется высокой реактивностью, в том числе взаимодействует с кислотными оксидами.
Взаимодействие цезия с кислотными оксидами происходит по аналогии с другими щелочными металлами. При контакте с оксидами цезий образует соли – цезиаты. Например, при взаимодействии цезия с оксидом азота (II) (N2O) образуется цесиат азота (II) (CsNO). Эта реакция происходит с выделением энергии в виде тепла и света.
Химическое взаимодействие цезия с кислотными оксидами является эндотермическим процессом, то есть требует затраты энергии. Однако искомые соединения обладают различными полезными свойствами, что делает их применение в научных и промышленных целях весьма актуальным.
Взаимодействие цезия с кислотными оксидами является одним из многочисленных примеров реакций, возникающих между щелочными металлами и кислотными оксидами. Эти реакции являются основой для получения разнообразных цесиатов, используемых в широком спектре областей, включая электронику, оптотехнику и каталитическую химию.
Примеры реакций щелочных металлов с различными кислотными оксидами
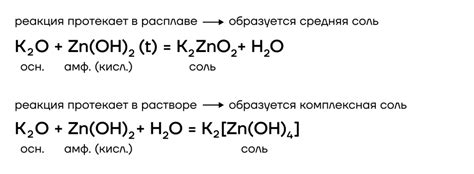
Реакции щелочных металлов с различными кислотными оксидами происходят в результате образования солей и выделения воды. Например, натрий реагирует с оксидом серы, образуя соль натрия и выделяя сернистый газ:
- 2Na + SO2 → Na2SO3
Аналогичная реакция может произойти при взаимодействии калия с оксидом серы:
- 2K + SO2 → K2SO3
Кроме того, щелочные металлы могут реагировать с оксидами азота. Например, при взаимодействии натрия с оксидом азота (II) образуется соль натрия и оксид азота (III):
- 2Na + N2O → 2NaNO
Подобная реакция может произойти при взаимодействии калия с оксидом азота (II):
- 2K + N2O → 2KNO
Таким образом, реакции щелочных металлов с кислотными оксидами приводят к образованию солей, которые являются основаниями, а также к выделению воды и образованию газов.
Вопрос-ответ

Какие щелочные металлы реагируют с кислотными оксидами?
Самые распространенные щелочные металлы, такие как натрий (Na), калий (K) и литий (Li), способны реагировать с кислотными оксидами.
Какие оксиды могут выступать в качестве кислотных оксидов?
В качестве кислотных оксидов могут выступать оксиды неметаллов, такие как оксид серы (SO2), оксид азота (NO2) и оксид углерода (CO2).
Как происходит реакция щелочных металлов с кислотными оксидами?
Реакция щелочных металлов с кислотными оксидами осуществляется через образование соли и воды. Например, реакция натрия с оксидом серы приводит к образованию сульфата натрия (Na2SO4) и воды (H2O).
