Серная кислота (H2SO4) является одним из наиболее распространенных неорганических кислот, широко используемых в различных отраслях промышленности. Взаимодействие серной кислоты с металлами является одной из основных реакций, которая часто применяется в химических исследованиях и промышленности.
Основной тип реакции между серной кислотой и металлом - это окислительно-восстановительная реакция, при которой серная кислота восстанавливается, а металл окисляется. В результате такой реакции могут образовываться соли серной кислоты и водород газ.
Некоторые металлы, такие как железо, алюминий и цинк, могут реагировать с серной кислотой, образуя соли серной кислоты и выделяя горючий водород газ. Например, реакция между серной кислотой и железом можно записать следующим образом:
Fe + H2SO4 -> FeSO4 + H2
В таблице приведены основные реакции взаимодействия серной кислоты с некоторыми металлами:
| Металл | Реакция |
|---|---|
| Железо (Fe) | Fe + H2SO4 -> FeSO4 + H2 |
| Алюминий (Al) | 2Al + 3H2SO4 -> Al2(SO4)3 + 3H2 |
| Цинк (Zn) | Zn + H2SO4 -> ZnSO4 + H2 |
Реакция серной кислоты с металлами: основные характеристики

Серная кислота (H2SO4) – это одна из наиболее распространенных и химически активных кислот. Она обладает сильной окислительной способностью и широко используется в промышленности и лабораторной практике.
Реакция серной кислоты с металлами представляет собой обмен протонов, в результате которого образуется соль и выделяется водород. Взаимодействие зависит от активности металла и концентрации кислоты, и может протекать с различной интенсивностью.
Основные характеристики реакции серной кислоты с металлами связаны с образованием сульфатов и выделением водорода. Металлы, как правило, реагируют с кислотой, образуя серные кислотные соли - сульфаты. При этом, некоторые металлы, такие как цинк, железо и алюминий, реагируют с серной кислотой с выделением водорода.
Реакция серной кислоты с металлами может протекать очень быстро, особенно если металл активный и концентрация кислоты высокая. Во время реакции может развиваться интенсивное пузырьковое сопротивление, сопровождаемое выделением водорода. Также, в результате реакции может образовываться характерный запах сульфата металла.
Свойства серной кислоты, важно знать
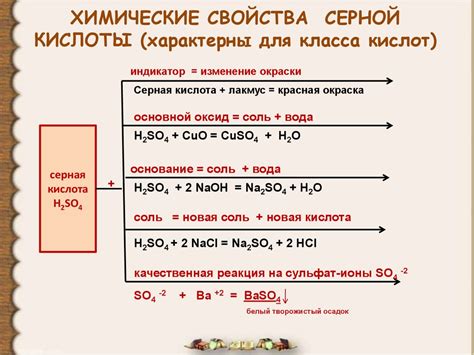
Серная кислота является одной из наиболее распространенных и важных неорганических кислот. Она обладает рядом уникальных свойств, которые делают ее незаменимым химическим соединением во многих сферах жизни.
Во-первых, серная кислота является сильной кислотой, что означает, что она способна донорировать протоны. Это свойство позволяет ей эффективно взаимодействовать с различными веществами и использоваться в различных химических процессах.
Во-вторых, серная кислота обладает высокой растворимостью в воде. Это делает ее удобной для использования в различных реакциях и процессах, где требуется равномерное распределение кислоты в растворе.
Кроме того, серная кислота обладает свойствами окислителя и дезинфицирующего средства. Она способна взаимодействовать с различными материалами, включая металлы, и вызывать химические реакции. Это позволяет использовать ее в различных производственных и хозяйственно-бытовых целях.
- Серная кислота может использоваться для очистки и обезжиривания поверхностей металлов перед нанесением защитного покрытия.
- Она также может применяться в процессе гальванизации для образования покрытий на металлических изделиях.
- Свойства серной кислоты позволяют ей использоваться в химическом синтезе для получения различных соединений.
Основываясь на своих уникальных свойствах, серная кислота является важным компонентом в различных отраслях промышленности, медицине и научных исследованиях. Владение знаниями о свойствах данной кислоты важно для обеспечения безопасного и эффективного ее использования.
Реакция серной кислоты с активными металлами
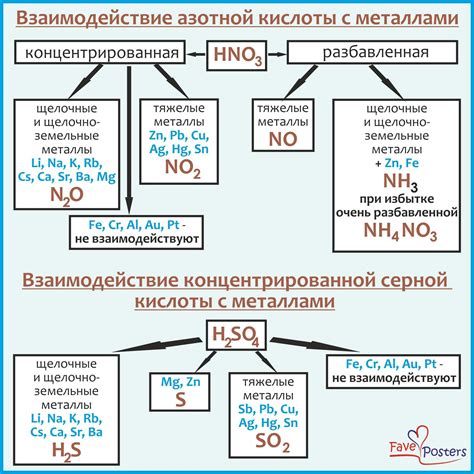
Серная кислота (H2SO4) обладает высокой активностью и способна проявлять химическую активность при взаимодействии с различными веществами. Взаимодействие серной кислоты с активными металлами представляет собой важную группу реакций, которые происходят с выделением водорода и образованием солей металлов.
Серная кислота, будучи двухосновным оксокислотом, имеет две кислотные группы и способна вытеснять менее активные кислоты из своих солей. В реакции с активными металлами, такими как натрий, калий или магний, происходит образование солей серной кислоты и выделение молекулярного водорода.
Эта реакция можно представить следующим уравнением: H2SO4 + 2M → MSO4 + 2H2, где M - активный металл. Такая реакция является типичной для серной кислоты и активных металлов.
Важно отметить, что при взаимодействии с активными металлами серная кислота обладает сильным окислительным действием, поэтому необходимо соблюдать осторожность при проведении данной реакции.
Реакция серной кислоты с переходными металлами
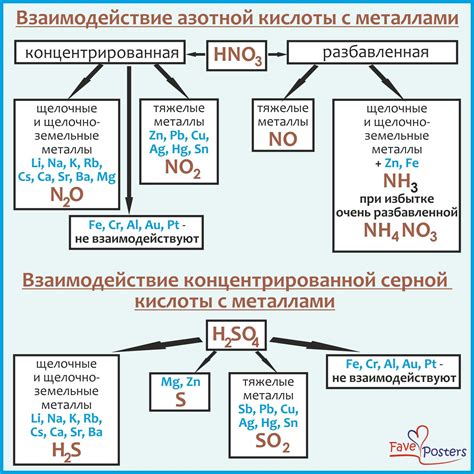
Серная кислота, или H2SO4, является одной из самых характерных и широко используемых кислот. Ее реакция с переходными металлами результативна и происходит при образовании соответствующих солей – сульфатов.
Переходные металлы, такие как железо (Fe), медь (Cu), цинк (Zn), никель (Ni) и другие, реагируют с серной кислотой при образовании соответствующих металлических сульфатов и выделении газа в виде сероводорода (H2S).
Например, реакция серной кислоты с железом приводит к образованию железного сульфата (FeSO4) и выделению сероводорода:
- Fe + H2SO4 = FeSO4 + H2S
Аналогично, при взаимодействии меди с серной кислотой образуются медный сульфат (CuSO4) и сероводород:
- Cu + H2SO4 = CuSO4 + H2S
Такие реакции могут быть использованы для получения соответствующих сульфатов и сероводорода в лабораторных условиях. Они также являются одним из способов получения сероводорода, который широко используется в промышленности.
Утилизация серной кислоты после взаимодействия с металлами

Серная кислота (H2SO4) является сильной кислотой и может образовывать реакционные смеси, которые сложно обрабатывать и утилизировать. После взаимодействия серной кислоты с металлами необходимо провести процесс утилизации, чтобы предотвратить загрязнение окружающей среды и сохранить безопасность.
Первый этап утилизации серной кислоты после взаимодействия с металлами - это нейтрализация. Для этого используют растворители, такие как щелочи или водные растворы щелочей. Ион гидроксида, присутствующий в щелочных растворах, реагирует с ионом водорода серной кислоты, образуя воду. Таким образом, pH реакционной смеси увеличивается и кислотность снижается.
Второй этап утилизации серной кислоты включает обработку полученного нейтрализованного раствора, чтобы избавить его от тяжелых металлов и других загрязняющих веществ, попавших изначально в серную кислоту. Для этого применяются различные методы, включая хлорирование, флотацию и осаждение с использованием специальных флокулянтов.
Окончательная стадия утилизации серной кислоты после взаимодействия с металлами - это обезвреживание и остаточная обработка отходов. Полученные отходы, содержащие серные соединения, не могут быть просто выброшены в окружающую среду, поэтому их следует подвергнуть процессу обработки, включающему фильтрацию и нейтрализацию, чтобы они стали безопасными для окружающей среды.
Общая схема утилизации серной кислоты после взаимодействия с металлами включает несколько этапов: нейтрализацию, удаление загрязняющих веществ и обработку остаточных отходов. Каждый этап требует тщательного контроля и соблюдения стандартов безопасности, чтобы обеспечить эффективную утилизацию и минимизировать вред для окружающей среды.
Как использовать серную кислоту для очистки металлических поверхностей

Серная кислота является мощным химическим реагентом, и ее можно успешно использовать для очистки металлических поверхностей от загрязнений, окислов и прочих нежелательных осадков. При правильном применении серная кислота позволяет достичь высокой эффективности и качества очищения.
Перед началом процесса очистки важно принять необходимые меры безопасности. При работе с серной кислотой следует надевать защитные перчатки и очки, чтобы защитить кожу и глаза от возможных ожогов. Также необходимо работать в хорошо проветриваемой области или использовать вытяжную систему, чтобы избежать вдыхания паров серной кислоты.
Процесс очистки металлической поверхности с использованием серной кислоты начинается с приготовления раствора кислоты. Для этого следует добавить воду в контейнер и медленно вливать серную кислоту, при этом необходимо соблюдать определенные пропорции и порядок смешивания. После полного растворения кислоты получается активное очищающее средство.
Следующим шагом является нанесение раствора на металлическую поверхность. Для этого можно использовать кисть, тряпку или специальный распылитель. Раствор нужно наносить равномерно, обеспечивая полное покрытие всей поверхности. Рекомендуется оставить раствор на поверхности на некоторое время, чтобы он выполнил свою очистительную функцию.
После окончания процесса очистки необходимо тщательно смыть остатки раствора с поверхности металла. Для этого рекомендуется использовать проточную воду, чтобы нейтрализовать действие кислоты. При необходимости повторите процесс очистки, чтобы достичь желаемого результата.
Важно помнить, что использование серной кислоты для очистки металлических поверхностей требует аккуратности и опыта. При неправильном применении кислоты может возникнуть риск повреждения металла или получения травмы. При сомнениях или отсутствии опыта лучше обратиться за помощью к специалисту или профессионалу в этой области.
Важность контроля реакции металла с серной кислотой
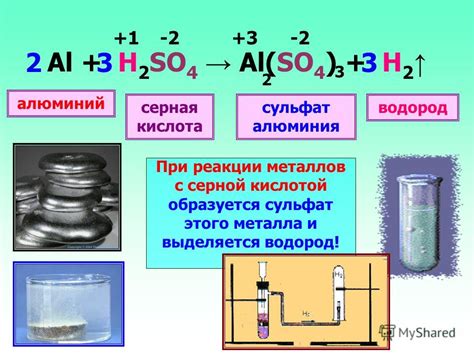
Взаимодействие металлов с серной кислотой является одной из основных реакций в химии. Важность контроля данного процесса заключается в его потенциальной опасности и возможности получения определенных продуктов.
При взаимодействии металла с серной кислотой происходит образование соли и выделение водорода. Данная реакция имеет широкое применение в различных областях науки и промышленности. Однако, не каждый металл может безопасно взаимодействовать с серной кислотой.
В связи с различной химической активностью металлов, необходимо контролировать реакцию с серной кислотой. Некоторые металлы, такие как цинк и железо, могут эффективно реагировать с серной кислотой, образуя соли и выделяя водород. Однако, другие металлы, например, ртуть и алюминий, реагируют более активно, сопровождаясь выделением дополнительных опасных продуктов в виде ядовитых паров и газов.
Правильный контроль реакции металла с серной кислотой имеет огромное значение в промышленном производстве, где этот процесс может использоваться для получения полезных продуктов или ставить под угрозу безопасность работников и окружающей среды. Также важно знать особенности взаимодействия разных металлов с серной кислотой для правильного выбора материалов в различных конструкциях и системах.
Таблица основных реакций металлов с серной кислотой

Серная кислота – сильная кислота, которая может реагировать с различными металлами, образуя соли серной кислоты (сульфаты). Реакция металлов с серной кислотой является реакцией окисления-восстановления.
Ниже приведена таблица основных реакций металлов с серной кислотой:
| Металл | Уравнение реакции | Соль серной кислоты |
|---|---|---|
| Цинк (Zn) | Zn + H2SO4 → ZnSO4 + H2 | Сульфат цинка (ZnSO4) |
| Железо (Fe) | Fe + H2SO4 → FeSO4 + H2 | Сульфат железа (FeSO4) |
| Медь (Cu) | 2Cu + H2SO4 → CuSO4 + SO2 + 2H2O | Сульфат меди (CuSO4) |
| Алюминий (Al) | 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 | Сульфат алюминия (Al2(SO4)3) |
| Церий (Ce) | 2Ce + 3H2SO4 → Ce2(SO4)3 + 3H2 | Сульфат церия (Ce2(SO4)3) |
Реакция металлов с серной кислотой происходит с выделением водорода и образованием соли. Образование солей является типичной реакцией окисления-восстановления, при которой металлу присваивается положительный окислительный номер, а серной кислоте – отрицательный.
Вопрос-ответ

Какие металлы реагируют с серной кислотой?
Серная кислота образует соединения с многими металлами, включая цинк, железо, алюминий, никель и медь.
Что происходит при реакции металлов с серной кислотой?
При реакции металлов с серной кислотой образуются соли и выделяется водородный газ.
Какие реакции возникают при взаимодействии цинка и серной кислоты?
В результате взаимодействия цинка и серной кислоты образуется соль цинка (сульфат цинка) и выделяется водородный газ. Уравнение реакции выглядит следующим образом: Zn + H2SO4 -> ZnSO4 + H2.
Какая таблица отражает реактивность металлов с серной кислотой?
Таблица активности металлов позволяет определить реактивность металлов при взаимодействии с серной кислотой. В этой таблице металлы располагаются от самых активных до наименее активных. Чем выше металл в таблице, тем большую скорость реакции он проявляет с серной кислотой.
