Оксиды металлов представляют собой химические соединения, состоящие из металлического и кислородного атомов. Они широко используются в промышленности и научных исследованиях благодаря своим уникальным свойствам. Концентрированная азотная кислота (HNO3) также является важным реактивом и имеет широкое применение в химической промышленности и аналитической химии.
Реакция оксидов металлов с концентрированной азотной кислотой происходит с образованием нитратов металлов и соответствующих продуктов окисления. Эта реакция является одной из наиболее известных и широкоиспользуемых реакций в химии. Процесс протекает при высоких температурах и способен вызывать интенсивные реакции окисления и разложения.
Свойства реакции оксидов металлов с концентрированной азотной кислотой зависят от химической природы металла и оксида, их структуры и степени окисления металла. Некоторые оксиды металлов обладают высокой устойчивостью к азотной кислоте и не реагируют с ней, в то время как другие оксиды металлов могут быть легко окислены до нитратов и разлагаться с образованием других продуктов.
Различные примеси могут повлиять на характер и скорость реакции оксидов металлов с концентрированной азотной кислотой. Например, добавление катализаторов или изменение температуры могут значительно изменить ход реакции.
Применение реакции оксидов металлов с концентрированной азотной кислотой включает как лабораторные, так и промышленные цели. В лаборатории эта реакция может использоваться для получения нитратов металлов, которые могут быть использованы в дальнейших химических исследованиях или для синтеза других соединений. В промышленности реакция может применяться в процессе производства удобрений, взрывчатых веществ или красителей.
Реакции оксидов металлов с концентрированной азотной кислотой: свойства и применение
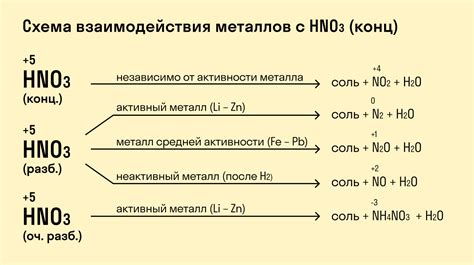
Реакции оксидов металлов с концентрированной азотной кислотой - это химические процессы, которые происходят при взаимодействии металлических оксидов с сильной окислительной средой азотной кислоты. С такими реакциями связаны ряд свойств, представляющих интерес как для теоретической химии, так и для практического применения.
Одним из важных свойств таких реакций является возможность получения азотистых соединений. В результате взаимодействия оксидов металлов с азотной кислотой образуются нитраты, которые находят широкое применение как удобрения для растений. Нитраты могут быть использованы для повышения плодородия почвы и увеличения урожайности сельскохозяйственных культур.
Еще одним важным свойством данных реакций является выделение окислительной энергии. При взаимодействии оксидов металлов с азотной кислотой происходит экзотермическая реакция, сопровождающаяся выделением тепла и возгоранием. Это свойство можно использовать, например, в промышленных процессах, где требуется поддерживание высоких температур или получение энергии в виде тепла.
Также реакции оксидов металлов с концентрированной азотной кислотой являются часто используемым методом очистки поверхности металлов от оксидных и коррозионных слоев. Азотная кислота является сильным окислителем и может растворять оксидные пленки, что позволяет восстановить металлическую поверхность. Такое применение данных реакций встречается в металлургии, электронике и других сферах промышленности.
Особенности взаимодействия металлических оксидов с азотной кислотой

Взаимодействие металлических оксидов с концентрированной азотной кислотой является одним из важных процессов в химии. При этом образуются азотистые оксиды и соответствующие соли металлов. Такое взаимодействие может происходить с различными оксидами металлов, такими как оксиды алюминия, железа, меди и других.
Особенностью этого процесса является интенсивное выделение газообразного диоксида азота в виде сильных раздражающих паров. В связи с этим, взаимодействие оксидов металлов с азотной кислотой происходит под контролем, с применением защитных мер и в специальных условиях.
Поведение металлических оксидов при их взаимодействии с азотной кислотой зависит от их химической природы и степени окисления. Например, оксид алюминия реагирует с азотной кислотой с образованием алюминатов, а оксид железа образует нитраты. Однако, эти реакции являются очень быстрыми и интенсивными, сопровождающимися выделением большого количества тепла.
Особенности взаимодействия металлических оксидов с азотной кислотой определяют их применение в различных областях. Например, алюминаты, полученные при реакции оксидов алюминия с азотной кислотой, широко используются в производстве красителей, катализаторов и других химических соединений.
Формирование нитратов металлов в результате реакции
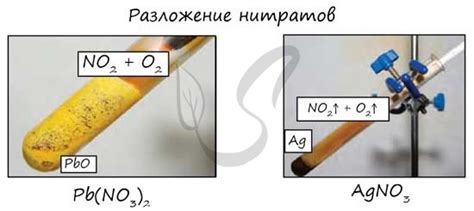
Реакция оксидов металлов с концентрированной азотной кислотой приводит к образованию нитратов металлов. Нитраты металлов - это соли, в которых металл ион связан с анионом нитрата (NO3-). Эта реакция является одним из способов получения нитратов.
В процессе реакции оксид металла (MxOy) реагирует с азотной кислотой (HNO3) при нагревании или взаимодействии в растворе. Реакция протекает по следующей схеме:
- Металлический оксид реагирует с азотной кислотой, образуя соль и воду.
- Соль, образовавшаяся в результате реакции, представляет собой нитрат металла (M(NO3)x).
Формирование нитратов металлов в результате реакции с азотной кислотой обуславливает ряд их свойств и применение. Нитраты металлов широко используются в промышленности, сельском хозяйстве, медицине и других отраслях. Они могут использоваться в качестве удобрений, взрывчатых веществ, пигментов, катализаторов и т.д. Некоторые нитраты, например, нитрат серебра, обладают антимикробными свойствами и используются в медицине для лечения инфекций.
Физические свойства нитратов металлов

Нитраты металлов – это соли азотной кислоты, в которых металл присутствует в качестве катиона, а нитрат-ион выполняет роль аниона. Физические свойства нитратов металлов определяют их состояние и поведение при различных условиях.
Одним из характерных свойств нитратов металлов является их растворимость в воде. Большинство нитратов металлов хорошо растворяются в воде, образуя прозрачные растворы. При этом растворение нитратов металлов сопровождается поглощением тепла, что обусловлено эндотермической реакцией.
В растворе нитратов металлов образуются ионы металла и нитрата, которые могут проявлять свои свойства. Например, ионы металла могут образовывать осадки, менять окраску или изменять pH раствора. Ионы нитрата, в свою очередь, участвуют в окислительно-восстановительных реакциях и могут оказывать влияние на степень окисления других веществ в системе.
Также стоит отметить, что многие нитраты металлов являются гигроскопичными веществами, то есть они способны притягивать влагу из окружающей среды. Именно поэтому нитраты металлов, хранящиеся в неплотно закрытой таре, могут образовывать влажные образцы. Некоторые нитраты металлов также имеют способность к кристаллизации из раствора, образуя кристаллические структуры различной формы.
Химические свойства нитратов металлов

Нитраты металлов - это соли нитратной кислоты, которые обладают определенными химическими свойствами. Они часто используются в различных отраслях промышленности и научных исследованиях благодаря своим уникальным химическим свойствам.
Один из основных химических характеристик нитратов металлов - их растворимость в воде. Большинство нитратов металлов хорошо растворимы в воде и образуют прозрачные растворы без видимых осадков. Это позволяет использовать нитраты металлов в химических реакциях и производстве различных соединений.
Некоторые нитраты металлов обладают окислительными свойствами. Например, нитрат меди(II) способен окислять различные вещества, такие как железные и оловянные соединения. Это позволяет использовать нитраты металлов в процессах окисления-восстановления и в промышленности при производстве пигментов, взрывчатых веществ и других продуктов.
Нитраты металлов также могут быть использованы в процессе каталитических реакций. Некоторые нитраты металлов, например нитрат равномерного никеля, обладают каталитической активностью и используются в различных каталитических процессах, таких как производство аммиака.
Применение нитратов металлов в промышленности

Нитраты металлов широко используются в различных отраслях промышленности благодаря своим особым свойствам и химической активности.
Прежде всего, нитраты металлов используются в производстве удобрений для сельского хозяйства. Богатые азотом нитраты являются важным источником питательных веществ для растений. Они способствуют улучшению питательной среды почвы, повышению ее фертильности и увеличению урожайности. Нитраты металлов, такие как нитрат аммония, нитрат калия и нитрат магния, применяются в аграрной промышленности для массового производства удобрений.
Кроме того, нитраты металлов используются в производстве пиротехнических композиций и взрывчатых веществ. Они служат окислителями и обеспечивают необходимый кислород для инициирования взрывных реакций. Например, нитрат стронция применяется для придания красного цвета пиротехническим изделиям, а нитрат бария – для создания зеленого цвета.
Еще одним применением нитратов металлов является использование их в производстве различных жидкостей и растворителей. Например, нитрат свинца применяется в процессе гальванизации, чтобы придавать поверхности металла определенные свойства, такие как стойкость к коррозии и улучшенная адгезия к краске. Нитраты металлов также могут использоваться в производстве красок, лаков и покрытий.
В заключение, нитраты металлов имеют широкий спектр применения в различных отраслях промышленности. Они используются как удобрения в сельском хозяйстве, как составные части пиротехнических изделий, а также в производстве жидкостей и растворителей. Благодаря своим химическим свойствам и универсальности, нитраты металлов остаются важными компонентами промышленных процессов.
Использование нитратов металлов в медицине
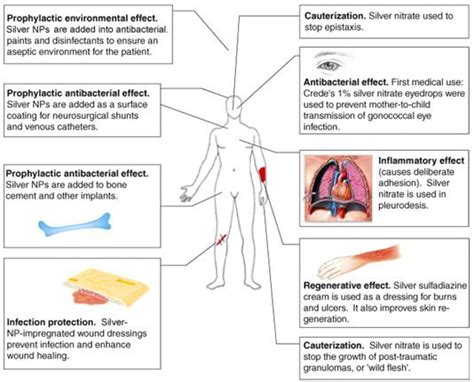
Нитраты металлов, такие как натрий, калий или аммоний нитраты, широко используются в медицине благодаря своим фармакологическим свойствам. Эти соединения обладают противоангинальными (расширяющими сосуды) и противозастойными (улучшающими кровообращение) эффектами, что делает их незаменимыми в лечении сердечно-сосудистых заболеваний.
Нитраты металлов широко применяются в виде лекарственных форм, таких как таблетки, капсулы, аэрозоли или растворы для инъекций. Они могут использоваться для профилактики и лечения стенокардии (боли в груди, вызванной недостаточным кровоснабжением сердца) и гипертензивного криза (острое повышение артериального давления).
Применение нитратов металлов в медицине требует строгого контроля и назначения со стороны врача. Они могут иметь побочные эффекты, такие как головная боль, покалывание или покраснение кожи. Поэтому необходимо соблюдать рекомендации врача по дозировке и продолжительности приема лекарства.
В целом, нитраты металлов представляют собой важный класс лекарственных средств, которые могут эффективно улучшать кровоснабжение и снижать нагрузку на сердце. Они широко применяются в медицине и продолжают быть объектом исследований для разработки новых лекарственных форм и методов применения.
Нитраты металлов в сельском хозяйстве

Нитраты металлов играют важную роль в сельском хозяйстве, так как они являются ценным источником питательных веществ для растений.
Многие растения нуждаются в нитратах металлов для нормального роста и развития. Например, азотные соединения, такие как нитраты, необходимы для синтеза белка, который является основным строительным блоком растительных тканей.
Кроме того, нитраты металлов также служат источником азота для микроорганизмов в почве, которые играют важную роль в цикле питательных веществ и поддержании биологической активности почвы.
Сельскохозяйственные предприятия часто используют нитраты металлов в качестве удобрений, чтобы обеспечить растения достаточным количеством азота. Они могут быть добавлены в почву перед посевом или вноситься в виде жидких растворов во время полива.
Однако следует отметить, что неконтролируемое использование нитратов металлов может быть вредным для окружающей среды и здоровья человека. Избыточное содержание нитратов в почве и воде может привести к загрязнению водоемов и проблемам с качеством питьевой воды. Поэтому важно соблюдать рекомендации по использованию и дозировке удобрений, содержащих нитраты металлов.
Перспективы исследований в области реакций оксидов металлов с азотной кислотой
1. Изучение механизмов реакций: Научные исследования в области реакций оксидов металлов с азотной кислотой ставят своей целью понять механизмы этих процессов. Изучение механизмов реакций позволяет не только расширить наши знания о взаимодействии оксидов металлов с азотной кислотой, но и положить основу для разработки новых способов синтеза важных соединений.
2. Поиск новых катализаторов: Реакции оксидов металлов с азотной кислотой могут происходить с участием катализаторов, которые значительно ускоряют эти процессы. Важным направлением исследований является поиск новых эффективных катализаторов для данных реакций. Это может привести к разработке новых методов синтеза важных соединений с помощью азотной кислоты.
3. Исследование наночастиц: Один из интересных аспектов исследований реакций оксидов металлов с азотной кислотой связан с использованием наночастиц металлов. Исследование влияния размера и формы наночастиц на процесс взаимодействия с азотной кислотой может помочь в разработке новых материалов с улучшенными свойствами.
4. Применение в различных отраслях: Реакции оксидов металлов с азотной кислотой имеют потенциал для применения в различных отраслях. Например, они могут использоваться в синтезе новых лекарственных препаратов, производстве удобрений, а также в электрохимических процессах, как катализаторы.
Вопрос-ответ

Какие реакции происходят между оксидами металлов и концентрированной азотной кислотой?
Реакция оксидов металлов с концентрированной азотной кислотой приводит к образованию нитратов металлов и выделению оксида азота или оксида азота(IV). Например, оксид меди(II) реагирует с азотной кислотой, образуя нитрат меди(II) и оксид азота(IV).
Какие свойства имеют полученные нитраты металлов?
Полученные нитраты металлов обычно являются растворимыми в воде с образованием хорошо проводящих электрический ток растворов. Они обладают различными свойствами в зависимости от металла и условий получения. Например, нитрат меди(II) применяется в качестве реактива для детекции анионов других веществ.
Какие практические применения имеют реакции оксидов металлов с концентрированной азотной кислотой?
Реакции оксидов металлов с концентрированной азотной кислотой находят применение в различных областях. Например, полученные нитраты металлов могут использоваться в химическом анализе для определения содержания определенных веществ. Кроме того, некоторые нитраты металлов применяются в качестве удобрений для растений или катализаторов в реакциях. Также, реакция оксидов металлов с азотной кислотой может применяться для получения конкретных соединений, которые могут быть использованы в различных процессах и технологиях.
