Реакции разложения нитратов металлов представляют собой важный объект изучения в области химии. Нитраты металлов — это соли, содержащие анионы нитрата и катионы металла. Под воздействием различных факторов таких как температура, давление и каталитические вещества, нитраты металлов могут разлагаться, выделяя различные продукты.
Одним из наиболее известных механизмов разложения нитратов металлов является термическое разложение. При нагревании нитраты металлов диссоциируют, образуя оксиды или гидроксиды металлов и выделяя газы, такие как оксид азота или азот. Термическое разложение нитратов находит широкое применение в различных областях, например, в создании пиротехнических составов.
Кроме термического разложения, нитраты металлов могут разлагаться под воздействием других факторов, таких как свет или электролиз. Фотолиз нитратов предполагает их разложение под воздействием света различной интенсивности и длины волны. Процесс электролиза также может способствовать разложению нитратов и образованию различных продуктов, включая металлы.
Изучение реакций разложения нитратов металлов имеет важное практическое значение, так как позволяет понять и контролировать химические процессы и получать необходимые продукты. Кроме того, эти реакции могут быть использованы в различных индустриальных процессах, в том числе при получении качественных взрывчатых веществ, удобрений и других полезных соединений.
Реакции разложения нитратов
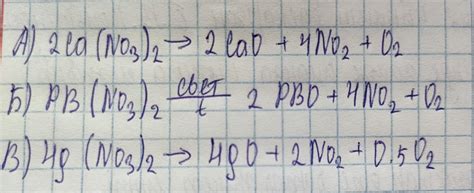
Нитраты металлов являются соединениями, содержащими ион нитрата (NO3-) и металлический ион. При нагревании нитраты металлов могут разлагаться, образуя окислы, оксиды и нитриты.
Разложение нитратов происходит в несколько стадий. Сначала при нагревании происходит обезвоживание нитрата, в результате чего образуется оксид азота и кислород. Затем происходит дальнейший распад оксида азота на азот и кислород или оксид. Оксиды азота могут претерпевать дальнейшие реакции, в результате которых могут образовываться другие оксиды или конечные продукты.
Реакции разложения нитратов металлов имеют широкое применение в различных областях. Например, разложение нитратов используется в пиротехнике для создания красителей, которые при горении выделяют яркие цвета. Также разложение нитратов может использоваться в процессе синтеза различных веществ, например, для получения оксидов металлов, которые могут использоваться в качестве катализаторов.
Также, реакции разложения нитратов металлов могут быть использованы для определения содержания металла в образце. Путем нагревания образца с нитратом металла и последующим измерением выделяющегося газа или полученного осадка можно определить количество металла в образце.
В заключение, реакции разложения нитратов металлов являются важными и полезными процессами, которые находят применение в различных областях науки и техники.
Механизм разложения нитратов металлов
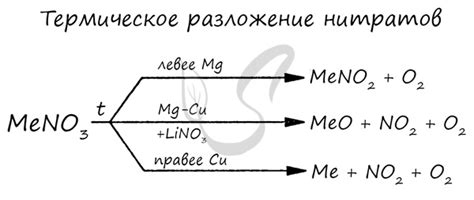
Нитраты металлов – соединения, которые широко применяются в различных отраслях промышленности и науки. В процессе разложения нитратов металлов происходит выделение газов и образование оксидов металлов. Механизм разложения зависит от типа металла и условий проведения реакции.
Разложение нитратов протекает в несколько этапов:
- Начальный этап – нагревание нитрата приводит к его декомпозиции и образованию оксида металла и выделению кислорода.
- Дальнейшее нагревание оксида металла приводит к разложению его на более низкие оксиды и выделению дополнительного объема кислорода.
- В конечном итоге, оксид металла может полностью разложиться до металла при достаточно высокой температуре.
Механизм разложения нитратов металлов определяется их термодинамическими свойствами, активностью ионообразующего металла, а также температурой и скоростью нагревания. Например, нитраты щелочных металлов разлагаются при комнатной температуре без нагревания, в то время как нитраты переходных металлов требуют высоких температур для декомпозиции.
Разложение нитратов металлов имеет широкое применение в различных областях, таких как производство взрывчатых веществ, каталитические процессы, синтез новых материалов и другие. Кроме того, данная реакция позволяет получать оксиды металлов, которые используются в качестве катализаторов, покрытий, веществ для электроники и других промышленных целей.
Применение разложения нитратов

Разложение нитратов металлов на окислители и кислоты является важным процессом в химической промышленности и лабораторной практике. Оно находит широкое применение в различных областях, включая производство удобрений, пиротехники, фотографии, анализа и многих других.
Одним из основных применений разложения нитратов является получение азотных удобрений. Разложение нитратов металлов, таких как аммоний, калия и кальция, позволяет получить чистый азот, который используется в производстве удобрений для повышения плодородия почвы.
Разложение нитратов также применяется в производстве пиротехнических смесей и взрывчатых веществ. Нитраты, такие как нитрат аммония или нитрат стронция, являются основными компонентами для создания различных эффектов в огненных шоу и пиротехнических изделиях. Разложение нитратов взрывчатые вещества подразумевает окисление металла и выделение значительного количества тепла и газов, что обеспечивает взрывную реакцию.
Разложение нитратов также широко используется в аналитической химии для определения концентрации и состава различных соединений. Полученные при разложении продукты могут быть анализированы и идентифицированы с помощью различных физических и химических методов.
В итоге, разложение нитратов металлов играет важную роль в различных отраслях промышленности и научных исследований. Контролируя этот процесс, можно получить различные продукты, которые находят применение в повседневной жизни.
Вопрос-ответ

Какие металлы образуют нитраты?
Нитраты могут образовываться с различными металлами, например, натрий (Na), калий (K), алюминий (Al), магний (Mg), железо (Fe), медь (Cu) и др. Образование нитратов зависит от способа взаимодействия металла с кислородом и азотом.
Как происходит разложение нитратов металлов?
Разложение нитратов металлов происходит с выделением кислорода и азота в виде газов. Это процесс, который называется термическим разложением. При нагревании нитраты металлов разлагаются на оксиды металлов, выделяя кислород и азот. Например, нитрат натрия (NaNO3) при нагревании разлагается на оксид натрия (Na2O), азот (N2) и кислород (O2).
Каков механизм разложения нитратов металлов?
Механизм разложения нитратов металлов связан с реакцией окисления-восстановления. В начале происходит окисление металла, при котором он переходит в более высокую степень окисления. Затем происходит восстановление, при котором окислитель (нитрат) разлагается с выделением газов. Этот процесс происходит при нагревании нитрата металла до определенной температуры.
Какие применения имеют разложения нитратов металлов?
Разложение нитратов металлов имеет различные применения. Например, разложение нитратов используется в производстве удобрений, когда нитраты металлов разлагаются для получения азотных соединений, необходимых для питания растений. Также разложение нитратов металлов может использоваться в промышленности для получения оксидов металлов, используемых в производстве различных материалов, например, стекла или керамики.
