Водород – вещество, которое играет важную роль в различных отраслях промышленности и науки. Этот газ весьма перспективен в качестве основного источника энергии будущего, так как его сжигание является безопасным и не приводит к выбросу вредных веществ в атмосферу. Кроме того, водород является необходимым компонентом в жизни растений и организмов, и, следовательно, важным объектом изучения для биологии и медицины.
Одним из наиболее распространенных методов получения водорода является реакция между металлом и кислотой. При этой реакции происходит окисление металла и одновременное восстановление водорода. Наиболее часто используемыми металлами при этом являются цинк, алюминий и железо. Кислоты, которые используются в данной реакции, в основном, сильные фосфорные, сульфатные или хлористоводородные кислоты.
В процессе реакции между металлом и кислотой довольно часто сложно произвести стандартные измерения количества образовавшегося водорода. Это связано с тем, что реакция происходит довольно быстро, а также совместная эволюция газа с кислотами и возможность образования пузырьков водорода на поверхности металла.
Важно отметить, что использование реакции между металлом и кислотой для получения водорода требует соблюдения определенных условий, таких как использование специального оборудования и тщательной регулировки соотношения компонентов. Также следует помнить о необходимости предосторожности и соблюдать все меры безопасности при проведении данной реакции.
В целом, реакция получения водорода с использованием металла и кислоты является одним из наиболее популярных и действенных методов получения этого газа. Она широко применяется в различных отраслях науки и промышленности и продолжает активно изучаться для разработки новых технологий и улучшения производственных процессов.
Свойства и применение водорода

Свойства
- Водород - самый легкий химический элемент, его атом входит в состав всех органических соединений.
- Водород обладает высокой горючестью - смесь водорода с кислородом образует взрывоопасный компонент, используемый в ракетостроении.
- При комнатной температуре и давлении, водород является газом без цвета и запаха.
- Водород обладает высокой теплопроводностью и низким плотностями.
- Водород обладает высокой гибкостью в применении и может быть использован в различных областях.
Применение
- Водород используется в производстве аммиака, которое, в свою очередь, является основным компонентом удобрений.
- Водород является ключевым компонентом при производстве металлов и драгоценных металлов в виде прочистого состояния.
- Водород применяется в пищевой промышленности для производства маргарина или в процессе гидрогенизации кукурузного масла.
- Также водород используется в ракетостроении, особенно в баках ракет для заправки.
- Водород используется в городском транспорте, водородные автомобили выделяют только воду при сгорании и не загрязняют окружающую среду.
Первоначальное понятие о водороде

Водород - это самый обычный, но при этом самый легкий химический элемент в таблице Менделеева. Он обычно изображается как H и имеет атомный номер 1. Водород является наиболее распространенным элементом во вселенной и составляет около 75% массы бытовых звезд. Он также находится в составе воды и на самом деле его имя произошло от греческого слова "вода" и "родитель".
Водород примечателен тем, что он может образовывать различные соединения и реагировать с другими элементами. Его мультиплицированная атомная формула H2 позволяет ему существовать в двухатомной форме, что делает его уникальным среди всех элементов. Это также делает его идеальным кандидатом для использования во множестве процессов и реакций.
Водород известен своими разнообразными свойствами, включая высокую теплопроводность, низкую плотность, огнеопасность и возможность образования взрывчатых смесей с воздухом. Это открывает широкий спектр применений водорода в различных отраслях, включая производство энергии, промышленность, научные исследования и транспорт.
Процессы получения водорода

1. Реакция металла с кислотой:
Один из самых распространенных способов получения водорода заключается в реакции металла с кислотой. При этом металл образует соль, а водород выделяется в виде газа. Например, при взаимодействии металла цинка с соляной кислотой образуется хлорид цинка и водород. Реакция протекает по следующему уравнению: Zn + 2HCl → ZnCl2 + H2.
2. Электролиз воды:
Другой способ получения водорода – это электролиз воды. При этом с использованием постоянного тока разлагается вода на кислород и водород. Водород выделяется на катоде, а на аноде образуется кислород. Уравнение реакции выглядит следующим образом: 2H2O → 2H2 + O2.
3. Пиролиз углеводородов:
Еще один метод получения водорода – это пиролиз углеводородов, таких как метан, этан и пропан. При нагревании этих веществ до высоких температур они разлагаются на водород и углерод. Например, метан при пиролизе превращается в водород и графит: CH4 → 2H2 + C.
4. Гидролиз соединений металлов:
Гидролиз – это реакция разложения вещества под действием воды. Соединения металлов, такие как натрий гидроксид и алюминий гидроксид, могут быть подвержены гидролизу, в результате которого образуется водород. Например, гидроксид натрия при гидролизе дает гидроксид алюминия и водород: 2NaOH + 2H2O → Al(OH)3 + 2H2.
5. Фотолиз воды:
Фотолиз – это реакция разложения вещества под действием света. В случае фотолиза воды водород и кислород образуются при освещении воды ультрафиолетовыми лучами или солнечным светом. Уравнение реакции выглядит следующим образом: 2H2O → 2H2 + O2.
Уравнение реакции получения водорода с использованием металла и кислоты

Реакция получения водорода с использованием металла и кислоты является экзотермической химической реакцией. В данной реакции между металлом и кислотой происходит образование водорода и соответствующих солей металла.
Для проведения данной реакции необходимо выбрать металл, способный реагировать с кислотой. Самым распространенным металлом для такой реакции является цинк (Zn). Реакция цинка с кислотой, например соляной (HCl) или серной (H2SO4), протекает с выделением водорода и образованием соответствующих солей цинка, таких как хлорид цинка (ZnCl2) или сульфат цинка (ZnSO4).
Уравнение реакции между цинком и соляной кислотой выглядит следующим образом:
- Zn + 2HCl → ZnCl2 + H2
Данная реакция полезна при получении водорода в лаборатории или промышленных условиях. Водород можно использовать в различных сферах, включая производство химических веществ, сжиженного газа или водородных топливных элементов. Кроме того, данная реакция является учебной моделью для изучения реакций между металлами и кислотами и основой для более сложных процессов.
Примеры реакций получения водорода с использованием металла и кислоты
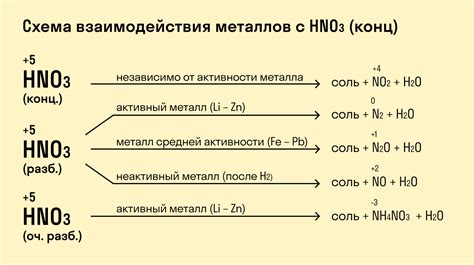
Реакция металла и кислоты является одним из самых распространенных методов получения водорода. Этот процесс основан на способности металлов образовывать ионы в водном растворе и реагировать с кислотой. В результате реакции образуется водородный газ и соответствующая соль металла.
Один из примеров такой реакции - реакция цинка с соляной кислотой. В результате этой реакции образуется хлорид цинка и водородный газ:
```html
Zn + 2HCl -> ZnCl2 + H2
```
Другим примером может служить реакция железа с серной кислотой. В этой реакции образуется сульфат железа и водородный газ:
```html
Fe + H2SO4 -> FeSO4 + H2
```
Также можно привести реакцию меди с соляной кислотой, в результате которой образуется хлорид меди и водородный газ:
```html
2Cu + 4HCl -> 2CuCl2 + H2
```
Эти примеры демонстрируют, как металлы реагируют с кислотами, выделяя водородный газ и образуя соли металлов. Реакции данного типа широко используются в промышленности для получения водорода и производства различных химических соединений.
Физические свойства водорода

1. Физическое состояние: Водород — это легкий и безцветный газ. При нормальных условиях (температуре и давлении) водород существует в виде двуатомных молекул H2, которые образуют газовую среду.
2. Молекулярная масса: Молекулярная масса водорода равна примерно 2,02 г/моль. Благодаря своей низкой массе, водород считается самым лёгким элементом в периодической системе химических элементов.
3. Плотность: Водород имеет очень низкую плотность. При нормальных условиях его плотность составляет около 0,089 г/л. Это означает, что водородный газ легче воздуха и может быстро восходить вверх.
4. Температура кипения и плавления: Температура кипения водорода составляет -252,8 °C, а температура плавления -259,14 °C. Такие низкие значения говорят о том, что водород находится в газообразном состоянии при обычных условиях окружающей среды.
5. Растворимость: Водород слабо растворяется в воде. При комнатной температуре и давлении его растворимость составляет около 0,015 г/л. Однако водород может растворяться в некоторых других веществах, таких как платина или никелевая губка.
6. Теплопроводность: Водород обладает высокой теплопроводностью. Он позволяет передавать тепло быстро и эффективно. Это свойство делает водород полезным в различных областях, таких как производство энергии.
7. Воспламеняемость: Водород является высокоэнергетическим газом и может воспламеняться при соприкосновении с огнём или искрами. При сгорании водорода образуется большое количество теплоты и обладает ярким пламенем.
Химические свойства водорода
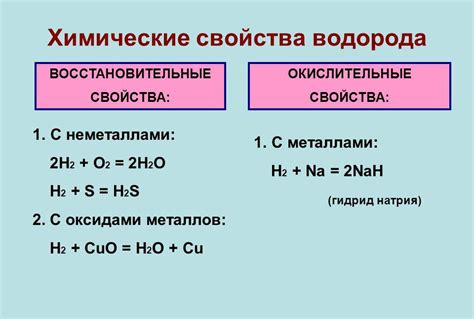
Водород – самый легкий и реакционно активный элемент в периодической системе химических элементов. Обладая только одним электроном в внешней оболочке, водород легко образует связи с другими элементами. Этот элемент проявляет такие химические свойства, как восстановительная активность и возможность образования ковалентных связей.
Водород реагирует с различными элементами, образуя специфические соединения. Например, с металлами водород может образовывать металловодороды, которые обладают взрывоопасными свойствами. С неметаллами он может образовывать молекулярные соединения, например кислород водород реагирует, образуя воду.
Водород обладает высокой восстановительной способностью, он может восстанавливать множество соединений и элементов. Вода соединяется с водородом с образованием водорода и гидроксида меди. Многие оксиды металлов восстанавливаются водородом до металлов. Водород также может восстанавливать многие неорганические и органические соединения.
Водород может быть использован во многих химических реакциях, таких как редокс-реакции, каталитические реакции, реакции замещения и другие. Также водород имеет высокую энергетическую ценность и может использоваться в качестве источника энергии.
Применение водорода в промышленности и научных исследованиях

Водород является одним из наиболее важных химических элементов, который широко применяется в различных отраслях промышленности и научных исследованиях.
В промышленности водород играет важную роль в процессе получения аммиака, который используется в производстве удобрений. Также водород применяется для получения гидрида лития, который используется в производстве лёгких и прочных материалов, включая батареи для электромобилей.
Водород используется в процессе производства металлов и сплавов. Он служит в качестве редуцирующего агента при получении стали, алюминия, меди и других металлов. Водород также применяется в процессе горения для высокотемпературной обработки металлов и резания металла с высокой скоростью.
В научных исследованиях водород играет роль важного инструмента для исследований в области квантовой химии и физики. Водород используется в качестве топлива для различных видов ядерных реакторов и установок. Он является ключевым компонентом водородных топливных элементов, которые могут быть использованы в производстве электроэнергии без выброса вредных веществ в окружающую среду.
Водород активно применяется в процессе исследования солнечной энергии и других возобновляемых источников энергии. Водородные топливные элементы позволяют хранить и использовать энергию, полученную от солнечных панелей и ветряных турбин. Это делает водород ключевым компонентом в развитии экологически чистых источников энергии.
Таким образом, применение водорода в промышленности и научных исследованиях имеет огромное значение для развития различных отраслей и достижения научного прогресса.
Вопрос-ответ

Для чего используется реакция получения водорода с использованием металла и кислоты?
Реакция получения водорода с использованием металла и кислоты применяется для производства водорода в промышленных масштабах. Такой метод является одним из наиболее распространенных способов получения водорода, который используется в различных промышленных процессах, а также в производстве водородных батарей и других устройств, работающих на водороде.
Как происходит реакция получения водорода с использованием металла и кислоты?
Реакция получения водорода с использованием металла и кислоты происходит при контакте кислоты с металлическим веществом. Например, при реакции цинка с соляной кислотой образуется цинковый ион и водород. Реакция протекает следующим образом: Zn + 2HCl → ZnCl2 + H2. Таким образом, металл реагирует с кислотой, образуя соль металла и выделяя молекулы водорода в газообразном состоянии.
Какова роль металла и кислоты в реакции получения водорода?
Металл играет роль редокс-агента в реакции получения водорода. Он окисляется, отдавая электроны, что позволяет протонам из кислоты соединиться и образовать молекулы водорода. Кислота, в свою очередь, предоставляет протоны для образования водорода. Таким образом, металл и кислота взаимодействуют, чтобы образовать соль металла и выделить молекулы водорода.
Какие металлы могут использоваться для реакции получения водорода с кислотой?
Реакция получения водорода с кислотой может протекать с различными металлами, включая цинк, железо, алюминий и другие. Однако не все металлы могут быть использованы для этой реакции. Например, медь или серебро не реагируют с обычными кислотами. Это связано с их химическими свойствами и способностью образовывать стабильные соединения.
