Плавиковая кислота, или HF, – это одна из наиболее известных неорганических кислот. Ее основное свойство – сильное коррозионное действие на металлы. Взаимодействие HF с металлами происходит через образование соответствующих солей. В зависимости от природы металла могут образовываться разные соединения, которые имеют различные свойства и применение.
Одним из наиболее интересных примеров реакций плавиковой кислоты с металлами является ее взаимодействие с алюминием. При контакте с HF алюминий образует комплексные соединения, которые отличаются высокой прочностью и стабильностью. Такие соединения широко используются в производстве алюминиевых сплавов и различных конструкций, требующих особой устойчивости к коррозии и высокой прочности.
Кроме алюминия,
плавиковая кислота активно взаимодействует с другими металлами, такими как цинк, магний, свинец, железо и многими другими.В каждом случае образуются уникальные соединения, которые находят применение в самых разных сферах науки и промышленности. Например, соединения плавиковой кислоты с металлами используются в электрохимических процессах, в производстве красок и лаков, а также в разработке катализаторов для химической промышленности.
Реакции плавиковой кислоты с металлами

Плавиковая кислота, или фтористоводородная кислота, HF, является одним из наиболее активных кислотных соединений, способных реагировать с различными веществами. Она образуется в результате диссоциации газообразного аниона фторида (F-) в присутствии воды или при нагревании соединений, содержащих фтор. Взаимодействие плавиковой кислоты с металлами является одной из наиболее изученных и широко применяемых реакций.
Плавиковая кислота может реагировать с металлами, образуя соединения, называемые фторидами металлов. Это происходит путем образования фторида металла и выделения молекулы воды. Например, реакция плавиковой кислоты с натрием (Na) приводит к образованию фторида натрия (NaF) и выделению молекулы воды:
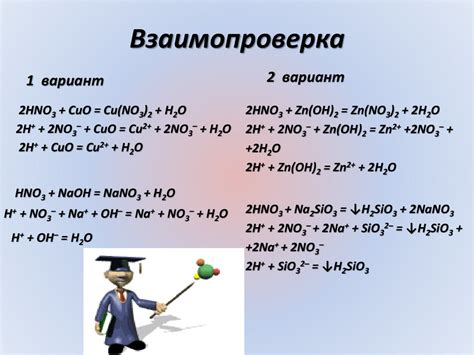
2HF + 2Na → 2NaF + H2O
Реакции плавиковой кислоты с металлами обладают рядом особенностей. Например, реакции с некоторыми активными металлами, такими как магний (Mg) или алюминий (Al), протекают очень быстро и с выделением большого количества газа - водорода. Это делает эти реакции очень опасными при работе с плавиковой кислотой.
Применение реакций плавиковой кислоты с металлами широко распространено в различных областях, включая химическую промышленность, электронику и автомобильную промышленность. Например, фториды металлов используются в процессах флотации при обработке руд, получении керамических и стеклянных материалов, производстве электронных компонентов и батарейных электродов, а также в качестве катализаторов в химических реакциях.
Химические свойства плавиковой кислоты

Плавиковая кислота, или фтористоводородная кислота (HF), является слабоикотной бинарной кислотой и сильным восстановителем. Она обладает рядом химических свойств, которые делают ее уникальным веществом в области химии металлов и в общей химии.
Агрессивность: Плавиковая кислота является одним из наиболее агрессивных химических веществ. Она способна растворять многие металлы, включая алюминий, железо, цинк, магний и даже платину. Эта кислота также может растворять стекло и керамику, что делает ее полезным растворителем в процессе электронного микроскопирования и металлографии.
Коррозионные свойства: Из-за своей агрессивности, плавиковая кислота может проникать в металлические поверхности и вызывать их коррозию. Это свойство позволяет использовать эту кислоту при очистке металлов от оксидных плёнок и других загрязнений.
Реакция с металлами: Когда плавиковая кислота взаимодействует с металлами, обычно образуется соль фторида металла и водород. Например, восстановление платины из раствора хлорида платины проводят с помощью плавиковой кислоты:
- 2PtCl4 + 14HF → 2H2PtF6 + 14HCl
- H2PtF6 + H2 → Pt + 6HF
Применение: Плавиковая кислота находит широкое применение в различных отраслях. Она используется для травления и гравировки стекла, а также для производства фторовых соединений. Ключевое применение кислоты связано с ее способностью растворять оксидные плёнки и загрязнения с поверхности металлов, например, в процессе электронной микроскопии и металлографии. Также она используется в качестве катализатора, при производстве полупроводников и в синтезе органических соединений.
Взаимодействие плавиковой кислоты с металлами

Плавиковая кислота, также известная как фтористоводородная кислота или HF, представляет собой сильную кислоту с характеристическими особенностями. Когда плавиковая кислота взаимодействует с металлами, происходят разнообразные химические реакции.
Одним из основных типов реакции является образование солей плавиковой кислоты. В этом случае плавиковая кислота выступает в качестве активного агента, а металл действует в качестве основы. Реакция приводит к образованию солей, что важно для различных промышленных и лабораторных процессов.
Взаимодействие плавиковой кислоты с металлами также может приводить к выделению водорода. Плавиковая кислота реагирует с металлами, освобождая молекулы водорода, которые могут быть использованы в различных промышленных процессах или в качестве источника энергии.
Однако важно отметить, что плавиковая кислота является очень опасным веществом и требует особой осторожности при его обращении. При работе с этой кислотой необходимо соблюдать правила личной безопасности и использовать соответствующую защитную экипировку, так как плавиковая кислота может вызывать серьезные ожоги и повреждения, а также является ядовитым веществом.
Окислительные свойства плавиковой кислоты
Плавиковая кислота, также известная как шестиокись фосфора, обладает выраженными окислительными свойствами. Это значит, что она способна принимать электроны от других веществ и саморазрушаться, переходя в состояние с меньшей окислительностью.
Окислительные свойства плавиковой кислоты активно применяются в различных отраслях науки и техники:
- Процесс окисления с помощью плавиковой кислоты используется в синтезе органических соединений. Кислота способна добавлять кислородные группы в молекулы органических веществ, что позволяет получать новые соединения с измененными свойствами.
- Плавиковая кислота применяется в производстве полупроводниковых приборов. В процессе травления пластины кремния она окисляет поверхность, образуя тонкую оксидную пленку, которая выполняет ряд важных функций.
- В сельском хозяйстве плавиковая кислота используется в качестве компонента некоторых удобрений. Ее окислительные свойства способствуют активному поставлению азота в доступной для растений форме.
Таким образом, окислительные свойства плавиковой кислоты делают ее важным инструментом в различных областях науки и техники. Это вещество способно активно взаимодействовать с другими веществами, открывая возможности для проведения различных химических реакций и получения новых соединений.
Коррозионная активность плавиковой кислоты
Плавиковая кислота, также известная как хлорная кислота, является химическим веществом, которое обладает высокой коррозионной активностью. Это означает, что она способна взаимодействовать с различными металлами, вызывая их разрушение и образование ожоговых повреждений.
Металлы, такие как железо, алюминий, цинк и многие другие, подвергаются серьезному воздействию плавиковой кислоты. Контакт с этой кислотой приводит к образованию хлоридов металлов, которые способны проникать в поверхность металла и вызывать его разрушение.
Коррозионная активность плавиковой кислоты является одним из главных факторов, определяющих ее применение. В промышленности плавиковую кислоту используют для удаления оксидной пленки с поверхности металлов перед их обработкой или покрытием. Она также используется для очистки радиаторов, отопительных систем и других металлических устройств от накопившихся отложений.
Также следует отметить, что плавиковая кислота обладает высокой плавучестью, что позволяет ей образовывать тонкий слой на поверхности металла и защищать его от воздействия окружающей среды. Однако при длительном воздействии кислоты на металлы происходит их постепенное разрушение, что необходимо учитывать при выборе материалов для различных конструкций и оборудования.
В целом, коррозионная активность плавиковой кислоты играет важную роль в различных промышленных процессах. Она обладает существенным воздействием на металлы и позволяет эффективно очищать их от окисных отложений. Однако при использовании плавиковой кислоты необходимо учитывать ее агрессивность и принимать соответствующие меры предосторожности, чтобы избежать нежелательных последствий.
Применение плавиковой кислоты в промышленности

Плавиковая кислота, также известная как гидрофторная кислота или фторводородная кислота, широко применяется в различных отраслях промышленности благодаря своим уникальным свойствам и реакционной способности.
Одним из главных применений плавиковой кислоты является ее использование в производстве сплавов и легированных металлов. Взаимодействие кислоты с металлами позволяет создавать специальные сплавы с улучшенными механическими и химическими свойствами. Такие сплавы находят применение в авиационной и автомобильной промышленности, производстве конструкционных материалов, а также в изготовлении инструментов и оборудования.
Плавиковая кислота также активно используется в процессе электрохимического производства. Ее реакционная способность и способность образовывать соли позволяют использовать ее в качестве электролита, например, при производстве алюминия или хлора. Благодаря своей высокой электропроводности и хорошей растворимости плавиковая кислота обеспечивает эффективность таких процессов и повышает их экономическую эффективность.
Кроме того, плавиковая кислота находит применение в производстве стекла. Она используется как реагент для электролитической декомпозиции натриевых и калиевых соединений, что позволяет получать стекло с определенными физическими и химическими свойствами. Благодаря этому, стекло, полученное с использованием плавиковой кислоты, обладает повышенной прочностью и устойчивостью к различным вредным воздействиям.
Роли плавиковой кислоты в химических процессах

Плавиковая кислота, также известная как гидрофторная кислота, является сильным кислотным соединением, которое играет важную роль во многих химических процессах.
Во-первых, плавиковая кислота широко используется в металлургии. Она может реагировать с металлами, такими как алюминий и железо, чтобы образовать соединения. Такая реакция называется фторированием и позволяет получать фториды металлов, которые являются важными компонентами в производстве различных материалов.
Кроме того, плавиковая кислота может использоваться для очистки и этилирования ранее использованных каталитических поверхностей. Это позволяет восстановить эффективность катализаторов, их селективность и стабильность.
Важным применением плавиковой кислоты является ее использование в производстве флуорополимеров и фторорганических соединений. Флуорополимеры обладают уникальными свойствами, такими как химическая стойкость и устойчивость к высоким температурам. Они находят применение в различных областях, таких как научные исследования, промышленность, медицина и электроника. Также, фторорганические соединения на основе плавиковой кислоты могут быть использованы в качестве межмолекулярных силовых агентов, добавок к смазкам и рабочим жидкостям, а также в других приложениях, где требуется их высокие антифрикционные и антипригарные свойства.
В итоге, плавиковая кислота выполняет важные функции в различных химических процессах. Она не только используется для получения фторидов металлов и очистки каталитических поверхностей, но и играет ключевую роль в осуществлении процессов производства флуорополимеров и фторорганических соединений, находяших применение во многих отраслях промышленности.
Вопрос-ответ

Что такое плавиковая кислота и какова ее химическая формула?
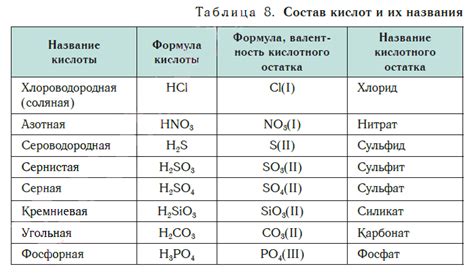
Плавиковая кислота (HF) – это двухатомная кислота, состоящая из одного атома фтора (F) и одного атома водорода (H). Ее формула выглядит так: HF.
Какие металлы реагируют с плавиковой кислотой?
Некоторые металлы, такие как алюминий (Al), железо (Fe) и никель (Ni), реагируют с плавиковой кислотой. Эти реакции приводят к образованию соответствующих солей и выделению водорода.
