Оксиды – это химические соединения, состоящие из металлического элемента и кислорода. В зависимости от степени окисления металла, они могут быть разделены на две основные группы – кислотные и основные оксиды. В данной статье рассмотрим примеры реакций основных оксидов с металлом.
Основные оксиды, как правило, обладают выраженными основными свойствами и способны образовывать соли с кислотными оксидами или кислотами. Реакция основного оксида с металлом обычно протекает с образованием гидроксида металла и выделением тепла.
Например, реакция оксида натрия (Na2O) с металлом алюминием (Al) приводит к образованию гидроксида натрия (NaOH) и выделению тепла:
2Na2O + 2Al → 2NaOH + Al2O3 + тепло
Таким образом, при реакции основного оксида натрия с металлом алюминием образуется гидроксид натрия и оксид алюминия.
Влияние основных оксидов на реакцию с металлом
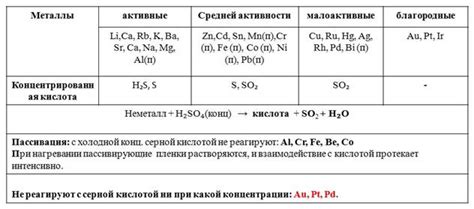
Основные оксиды являются химическими соединениями, состоящими из кислорода и металла, которые способны образовывать щелочные растворы. Взаимодействие основных оксидов с металлами приводит к образованию солей и выделению воды.
Важно отметить, что скорость и характер реакции зависят от типа металла и его активности. Некоторые металлы, такие как алюминий и магний, обладают высокой реактивностью и способны быстро вступать в реакцию с основными оксидами, образуя соли. Такие реакции обычно сопровождаются выделением тепла и газов, так как металлы меняют свое окисление.
Другие металлы, например железо или цинк, могут реагировать более медленно или даже не реагировать с некоторыми основными оксидами. Это связано с их низкой реактивностью и стабильностью. Однако с некоторыми основными оксидами, например с оксидом железа(III), металлы также могут образовывать соли и изменять свое окисление.
Интересно, что в реакции между основными оксидами и металлами может принимать участие вода как реагент. Некоторые металлы реагируют с основными оксидами и водой одновременно, что увеличивает скорость реакции и образует более сложные соединения.
В заключение, взаимодействие основных оксидов с металлами является важным процессом в химических реакциях. Знание о реакции основных оксидов с металлами позволяет ученым и инженерам контролировать и использовать эти реакции для создания новых материалов и процессов.
Оксид калия и его реакция с металлом в воде

Оксид калия (К2O) – это основной оксид, в составе которого содержится кислород и калий. Он образуется при сгорании калия в кислороде или при нагревании калиевых соединений. Оксид калия обладает щелочными свойствами и растворяется в воде, образуя щелочную реакцию.
Реакция оксида калия с металлом в воде осуществляется по следующему сценарию:
- Оксид калия взаимодействует с водой, образуя гидроксид калия и выделяя тепловую энергию:
- К2O + H2O → 2 KOH + Q
- 2 KOH + 2 M → 2 M(OH)2 + H2↑
Таким образом, оксид калия может прореагировать с металлами в воде, приводя к образованию гидроксидов металлов и выделению водорода. Реакция является экзотермической, то есть сопровождается выделением тепловой энергии.
Взаимодействие металла с оксидом натрия

Оксид натрия (Na2O) является основным оксидом, который образуется при соединении натрия с кислородом. Когда металл взаимодействует с оксидом натрия, происходит химическая реакция, результатом которой является образование соединения между металлом и натрием.
При взаимодействии металла с оксидом натрия, металл вытесняет натрий из соединения, образуя свое собственное оксидное соединение с кислородом. Например, взаимодействие алюминия (Al) с оксидом натрия приводит к образованию оксида алюминия (Al2O3) и натрия (Na).
Такое взаимодействие металлов с оксидом натрия происходит в соответствии с реакцией:
2Al + Na2O → Al2O3 + 2Na
Такая реакция протекает с выделением большого количества тепла и могут возникать пожары. Поэтому необходимо проявлять осторожность и предпринимать соответствующие меры безопасности при работе с такими реагентами.
Реакция оксида кальция с металлом

Оксид кальция (CaO) – основной оксид, который образуется при сгорании кальция в кислороде или при нагревании кальция с кислородом. Взаимодействие этого оксида с металлом приводит к проведению химической реакции.
Реакция оксида кальция с металлом может протекать по разным механизмам, в зависимости от особенностей взаимодействующих веществ. Некоторые металлы могут реагировать с оксидом кальция путем обменной реакции, образуя соответствующие соли и освобождая кальций. Например, при взаимодействии натрия с оксидом кальция образуется хлорид натрия и кальций:
2Na + CaO -> CaCl2 + Na2O
В других случаях металл может реагировать с кислородом оксида кальция, образуя оксид металла и освобождая кальций. Например, при взаимодействии железа с оксидом кальция образуется оксид железа и кальций:
3Fe + CaO -> Ca + Fe3O4
Реакция оксида кальция с металлом может протекать с выделение тепла и света. Также могут образовываться продукты в виде пены или тугоплавкого осадка, в зависимости от условий проведения реакции.
Важно отметить, что реакция оксида кальция с металлом может использоваться в промышленности при получении металлических соединений или при обработке металлических поверхностей.
Влияние оксида магния на металлические элементы

Оксид магния (MgO) – это химическое соединение, которое широко используется в промышленности, медицине и строительстве. Его влияние на металлические элементы может быть различным в зависимости от условий их взаимодействия.
Одним из наиболее распространенных применений оксида магния является его использование в металлургической промышленности для снижения содержания серы и фосфора в стали. Оксид магния взаимодействует с этими примесями и образует стабильные соединения, которые легко удаляются из металла.
Оксид магния также используется в производстве алюминия. В этом процессе оксид магния служит флюсом, который позволяет удалить примеси и улучшить качество конечного продукта. Кроме того, наличие оксида магния в алюминиевых сплавах повышает их прочность и устойчивость к коррозии.
Влияние оксида магния на металлические элементы также может быть отрицательным. Например, при высоких температурах оксид магния может взаимодействовать с алюминием и образовывать нежелательные соединения, которые могут ухудшить свойства материала.
Оксид магния также может влиять на поверхность металла, изменяя его структуру и свойства. Например, при взаимодействии с оксидом магния поверхностный слой металла может стать более плотным и устойчивым к коррозии.
В целом, влияние оксида магния на металлические элементы зависит от конкретного условия взаимодействия и свойств металла. Использование оксида магния может быть полезным для улучшения качества и свойств металлических материалов, однако необходимо учитывать потенциальные негативные последствия и проводить дополнительные исследования и испытания.
Оксид железа и его реакционная способность с металлами
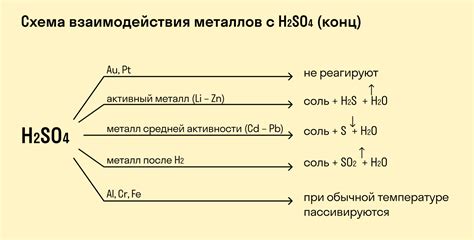
Оксид железа (Fe2O3) - это химическое соединение, состоящее из двух атомов железа и трех атомов кислорода. Он широко распространен в природе и имеет несколько различных форм, включая гематит, магнетит и губку железа.
Оксид железа является основным оксидом, что означает, что он может реагировать с кислотами для образования солей и воды. Однако его реакционная способность с металлами не так явна.
Оксид железа взаимодействует с некоторыми металлами и образует соответствующие соли. Например, он реагирует с металлами группы 1, такими как натрий (Na) и калий (K), образуя соответствующие соли - нитрат натрия (NaNO3) и нитрат калия (KNO3). Эта реакция осуществляется при нагревании и сопровождается выделением кислорода.
Оксид железа также может реагировать с металлами группы 2, такими как магний (Mg) и кальций (Ca), образуя соответствующие соли. Например, реакция оксида железа с магнием приводит к образованию нитрата магния (Mg(NO3)2). Это также происходит при нагревании и сопровождается выделением кислорода.
Однако оксид железа не реагирует с некоторыми металлами, такими как алюминий (Al) и медь (Cu). Это объясняется тем, что эти металлы обладают достаточно низкой реакционной способностью или образуют пассивные пленки на своей поверхности, которые препятствуют дальнейшей реакции.
Таким образом, оксид железа проявляет реакционную способность с некоторыми металлами, образуя соответствующие соли и выделяя кислород. Это является одним из многих аспектов его химических свойств и позволяет использовать его в различных процессах и применениях.
Вопрос-ответ

Что такое основные оксиды?
Основные оксиды - это химические соединения, в которых кислотные оксиды реагируют с водой и образуют основания. Они обладают щелочными свойствами и могут нейтрализовать кислоты.
Какие металлы реагируют с основными оксидами?
Многие металлы могут реагировать с основными оксидами. Например, щелочные металлы, такие как натрий и калий, реагируют с оксидами, образуя соответствующие основания. Также алюминий и цинк могут реагировать с основными оксидами, образуя соли и воду.
