Оксиды щелочных металлов, включающие такие элементы, как натрий, калий, литий, цезий и рубидий, проявляют уникальные свойства при взаимодействии с щелочью. Данный процесс, известный также как гидролиз, сопровождается рядом химических реакций, которые важны не только с точки зрения науки, но и имеют практическое применение.
Одной из основных особенностей взаимодействия оксидов щелочных металлов с щелочью является высвобождение гидроксидов. При соприкосновении оксида с щелочью происходит реакция, в результате которой выделяется вода и образуется гидроксид. Например, оксид натрия (Na2O) и щелочь (NaOH) взаимодействуют по следующему уравнению: Na2O + 2NaOH → 3Na2OН.
Помимо образования гидроксидов, также возможно образование солей при взаимодействии оксидов щелочных металлов с кислотой. Данный процесс проявляется в случае, если щелочь присутствует не только в виде гидроксида, но и в виде карбоната или гидрокарбоната. Такое взаимодействие можно представить следующей формулой: Na2O + CO2 + H2O → 2NaHCO3.
Таким образом, взаимодействие оксидов щелочных металлов с щелочью является многосторонним процессом, который проявляет особенности в виде образования гидроксидов и солей. Изучение этих реакций имеет не только теоретическое, но и практическое значение для понимания и применения этих процессов в различных областях науки и техники.
Взаимодействие оксидов щелочных металлов с щелочью

Оксиды щелочных металлов взаимодействуют с щелочью, образуя гидроксиды. Эта реакция является реакцией нейтрализации, в которой ионы гидроксида щелочи и ионы оксида щелочного металла соединяются, образуя стабильное вещество - гидроксид.
Взаимодействие оксидов с щелочью происходит при добавлении оксида в воду или раствор щелочи. При этом происходит выделение большого количества тепла и образование щелочного раствора сопровождается химической реакцией. В результате этого процесса оксид полностью растворяется в воде или щелочном растворе.
При взаимодействии оксидов щелочных металлов с щелочью образуются гидроксиды, которые обладают щелочными свойствами. Гидроксиды щелочных металлов являются сильными основаниями и образуют щелочные растворы. Они широко используются в промышленности и в бытовых целях.
Взаимодействие оксидов щелочных металлов с щелочью является важным процессом в химии и имеет много применений. Это образование гидроксидов является одной из основных реакций при производстве различных щелочей и щелочных растворов. Знание данных реакций позволяет контролировать и управлять этими процессами.
Особенности смешения оксидов щелочных металлов

Оксиды щелочных металлов – это неорганические соединения, состоящие из кислорода и металла. Щелочные металлы включают в себя литий, натрий, калий, рубидий и цезий. Смешение оксидов щелочных металлов может происходить как с другими оксидами, так и с щелочами.
Смешение оксидов щелочных металлов с щелочью может привести к различным реакциям. Например, при смешении оксида щелочного металла с водой образуется щелочь. Реакция происходит с выделением тепла и образованием гидроксида щелочного металла.
Особенности смешения оксидов щелочных металлов с другими оксидами могут быть различными. Некоторые оксиды щелочных металлов могут реагировать с оксидами других металлов, образуя соли или сложные соединения. Например, смешение оксида калия с оксидом цинка может привести к образованию калийцинка. В таких реакциях металлы щелочных металлов проявляют свою химическую активность и способность образовывать стабильные соединения.
Другой особенностью смешения оксидов щелочных металлов является их растворимость. Оксиды щелочных металлов обычно хорошо растворяются в воде, образуя щелочные растворы. Это связано с их способностью образовывать ионный раствор. Растворимость оксидов щелочных металлов может зависеть от их концентрации, температуры и других факторов.
В заключение, смешение оксидов щелочных металлов обладает своими особенностями, которые определяются их реактивностью и физико-химическими свойствами. Они могут реагировать с щелочью, образуя гидроксиды, а также с другими оксидами, образуя соли и сложные соединения. Их растворимость в воде сделает их доступными для различных химических реакций и применений.
Влияние окислительных свойств оксидов на реакции с щелочью

Оксиды щелочных металлов являются химическими соединениями, которые могут проявлять как основные, так и окислительные свойства. В реакциях с щелочью, окислительные свойства оксидов играют важную роль и определяют их химическую активность и возможность реакции.
Оксиды щелочных металлов, такие как оксид натрия (Na2O), оксид калия (K2O) и оксид лития (Li2O), могут проявлять окислительные свойства и быть действующими окислителями в реакциях с щелочью. Они способны отбирать электроны от щелочи, что приводит к образованию ионов металла и образованию воды.
При взаимодействии оксидов щелочных металлов с щелочью возникают сильно щелочные растворы, которые могут иметь различные применения в разных областях, таких как производство щелочей, стекла и керамики.
Оксиды щелочных металлов также могут реагировать с водой, образуются гидроксиды, которые в свою очередь проявляют мощные щелочные свойства. Реакции оксидов с щелочью могут проходить с выделением тепла и образованием сложных соединений.
Взаимодействие оксидов щелочных металлов с щелочью является важным процессом в химической промышленности и научных исследованиях, и понимание его механизмов позволяет разрабатывать и применять различные технологии и продукты.
Химические реакции смешения щелочных металлов с щелочью
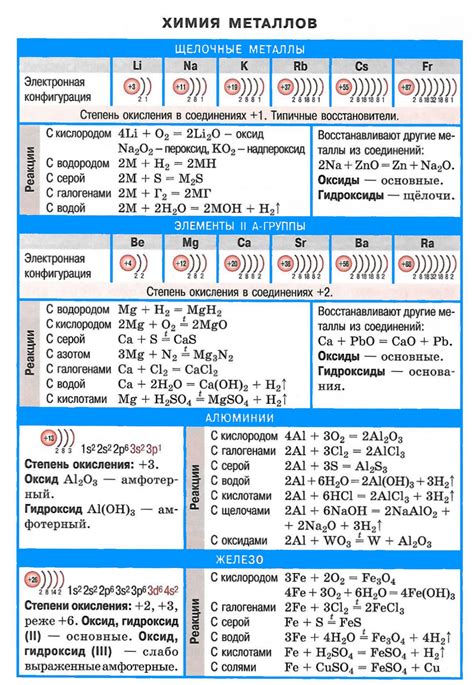
Соединение щелочных металлов и щелочей, таких как гидроксиды натрия и калия, приводит к химическим реакциям, которые не только изменяются в зависимости от реагентов, но и имеют определенные особенности.
Одной из основных особенностей реакции является образование солей щелочных металлов и воды. В процессе реакции ионы щелочных металлов обмениваются с ионами гидроксида, образуя натриевую или калиевую соль и воду. Это является одной из наиболее распространенных реакций смешения щелочных металлов с щелочью.
Процесс происходит с выделением большого количества тепла, что приводит к значительному повышению температуры смеси. Реакция также сопровождается образованием пенящегося вещества — гидроксида щелочного металла. Данные особенности могут быть полезными при проведении определенных химических реакций и приготовлении некоторых продуктов.
Другой интересной особенностью реакции является способность щелочей растворять металлы. Примесь щелочного металла в щелочи может вызвать реакцию с образованием гидроксидов металлов и выделением водорода. Это свойство может применяться для очистки металлов от оксидных пленок и ржавчины.
Формирование основных солей при взаимодействии щелочных металлов с щелочами

Тщательно очищенные образцы щелочных металлов (например, натрия, калия или рубидия) вступают в реакцию с щелочами, такими как гидроксид натрия или гидроксид калия. При этом происходит формирование основных солей, которые состоят из катиона щелочного металла и аниона гидроксида.
В результате реакции образуется щелочный гидроксид, который растворяется в воде, образуя щелочную растворимую соль. Образование основных солей при взаимодействии щелочных металлов с щелочами является химической реакцией, сопровождающейся выделением тепла.
Реакция между щелочным металлом и щелочью может протекать с различной интенсивностью в зависимости от конкретных условий, таких как температура, концентрация реагентов и длительность реакции. Иногда для активации реакции необходимо применение катализатора или повышение температуры.
В результате взаимодействия щелочного металла с щелочью образуется очень щелочной раствор, который может быть использован в различных процессах и технологиях. Основные соли, полученные при таких реакциях, имеют широкое применение в промышленности и медицине.
Термическое разложение оксидов щелочных металлов в реакции с щелочью

Термическое разложение оксидов щелочных металлов является важной составляющей при взаимодействии с щелочью. Оксиды щелочных металлов представляют собой соединения, в которых металл связан с кислородом. В процессе взаимодействия с щелочью происходит разложение оксидов с образованием основания и выделением кислорода.
Термическое разложение оксидов щелочных металлов может происходить при различных температурах. Например, оксид натрия (Na₂O) может разлагаться уже при комнатной температуре, выделяя кислород и образуя гидроксид натрия (NaOH). При повышении температуры разложение оксида натрия более интенсивно, что может использоваться в промышленности для получения большего количества газообразного кислорода.
Термическое разложение оксидов щелочных металлов сопровождается значительным выделением энергии. Это можно наблюдать при проведении реакции в открытой системе, при которой может происходить вспышка или искристый вылет кислорода. Поэтому при работе с оксидами щелочных металлов необходимо соблюдать меры предосторожности и проводить реакцию в безопасной среде.
Термическое разложение оксидов щелочных металлов в реакции с щелочью демонстрирует способность щелочных металлов образовывать сильные основания и выделять кислород. Это свойство находит применение в различных областях науки и промышленности, включая производство газообразного кислорода, получение гидроксидов щелочных металлов и других важных соединений. Термическое разложение оксидов щелочных металлов представляет собой сложную и интересную химическую реакцию, изучение которой помогает понять особенности взаимодействия веществ и их применение в различных процессах.
Взаимодействие гидроксидов щелочных металлов с щелочью
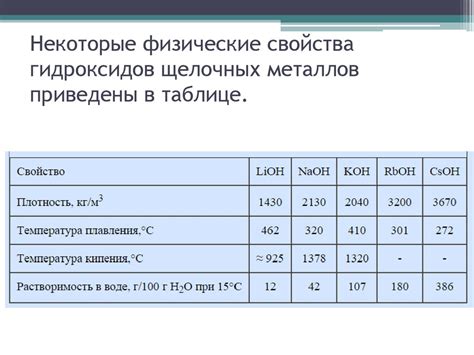
Гидроксиды щелочных металлов являются основаниями и проявляют сильную щелочность. При взаимодействии гидроксидов щелочных металлов с щелочью происходит образование солей и воды.
Процесс взаимодействия гидроксидов щелочных металлов с щелочью можно описать следующей реакцией:
NaOH + KOH → NaK + H2O
В результате данной реакции образуются соль NaK и молекула воды. Гидроксиды щелочных металлов обладают свойством диссоциировать в водных растворах, ионизируясь на катион щелочного металла и гидроксидную группу.
Взаимодействие гидроксидов щелочных металлов с щелочью является экзотермическим процессом, то есть сопровождается выделением тепла. В результате этого взаимодействия образуется стабильная соль, которая является химически инертной и может использоваться в различных областях промышленности.
Важно отметить, что взаимодействие гидроксидов щелочных металлов с щелочью может происходить только при присутствии воды. Вода является необходимым компонентом для реакции, так как обеспечивает диссоциацию гидроксида и образование ионов щелочного металла.
Использование реакций оксидов щелочных металлов с щелочью в промышленности

Реакции оксидов щелочных металлов с щелочью являются важным процессом в промышленности. Эти реакции используются для производства различных продуктов, включая щелочные соли, стекло и керамику.
Одним из основных применений этих реакций является получение щелочных солей, таких как гидроксид натрия и гидроксид калия. Эти соединения широко используются в различных отраслях промышленности, включая производство мыла, бумаги, стекла, металлических изделий и других продуктов.
Кроме того, реакции оксидов щелочных металлов с щелочью используются для получения стекла и керамики. Они являются основой процесса стеклотоварного производства, позволяя получить прочные и прозрачные материалы с различными свойствами. Также эти реакции применяются в керамической промышленности для создания разнообразных изделий, включая посуду, плитку и санитарно-техническую керамику.
Для контроля и оптимизации данных реакций в промышленности используются различные технологии. Это включает автоматизацию процессов, использование специальных реакторов и контрольных систем, а также анализ и контроль качества получаемых продуктов. Все это позволяет достичь высокой эффективности и стабильности процессов производства.
Таким образом, использование реакций оксидов щелочных металлов с щелочью в промышленности имеет широкое применение и является важным этапом в производстве различных продуктов, включая щелочные соли, стекло и керамику.
Значение взаимодействия оксидов щелочных металлов с щелочью в научных исследованиях

Взаимодействие оксидов щелочных металлов с щелочью является предметом множества научных исследований. Это связано с тем, что данная реакция имеет большое значение для понимания физико-химических процессов, происходящих в системах с участием щелочных металлов.
Оксиды щелочных металлов обладают выраженными основными свойствами и способностью образовывать сильные щелочные растворы взаимодействием со щелочью. Исследование этой реакции позволяет установить закономерности процесса, изучить состав продуктов взаимодействия, определить влияние различных факторов на ход реакции.
Важным аспектом исследования взаимодействия оксидов щелочных металлов с щелочью является определение энергии сопряженных реакций и термодинамических параметров. Также интерес представляет изучение кинетических характеристик этой реакции, включая скорость реакции, активационные энергии и зависимость от температуры.
Результаты исследований взаимодействия оксидов щелочных металлов с щелочью имеют практическое значение для различных отраслей промышленности и технологий. Например, эти данные могут быть использованы при разработке процессов синтеза щелочных растворов, а также при создании новых материалов и технических решений для химической промышленности. Кроме того, результаты исследований позволяют более глубоко понять механизмы реакции между щелочными металлами и оксидами, что может привести к разработке новых методов синтеза и улучшению существующих технологий.
Вопрос-ответ

Какие особенности есть при взаимодействии оксидов щелочных металлов с щелочью?
При взаимодействии оксидов щелочных металлов с щелочью происходит реакция образования гидроксидов. Эта реакция является экзотермической и сопровождается выделением тепла. Особенностью этой реакции является то, что оксиды щелочных металлов растворяются в воде, образуя гидроксиды щелочных металлов. Например, натриевый оксид (Na2O) растворяется в воде, образуя натриевый гидроксид (NaOH).
Какие реакции происходят при взаимодействии оксидов щелочных металлов с щелочью?
При взаимодействии оксидов щелочных металлов с щелочью происходят реакции образования гидроксидов. Например, оксид натрия (Na2O) реагирует с водой, образуя натриевый гидроксид (NaOH): Na2O + H2O → 2NaOH. Также оксид калия (K2O) реагирует с водой, образуя калиевый гидроксид (KOH): K2O + H2O → 2KOH. Эти реакции являются экзотермическими и сопровождаются выделением тепла.
Как происходит взаимодействие оксидов щелочных металлов с щелочью?
Взаимодействие оксидов щелочных металлов с щелочью происходит путем реакции образования гидроксидов. При этом оксид щелочного металла растворяется в воде и образует гидроксид щелочного металла. Например, оксид натрия (Na2O) реагирует с водой, образуя натриевый гидроксид (NaOH): Na2O + H2O → 2NaOH. Эта реакция является экзотермической и сопровождается выделением тепла.
