Оксид азота (NO) – это важное химическое соединение, которое обладает широким спектром действия во многих областях науки и техники. В частности, его взаимодействие с металлическими материалами является предметом активного изучения и находит применение в различных технологиях.
Одной из особенностей взаимодействия оксида азота с металлами является его способность образовывать стабильные комплексы с ионами металлов. Такие комплексы могут иметь различную природу и структуру, что определяет их потенциальные физические и химические свойства. Это свойство оксида азота позволяет использовать его в катализе и других процессах, связанных с применением металлических материалов.
Важным аспектом взаимодействия оксида азота с металлами является его электрохимическая активность. Оксид азота обладает способностью служить в качестве окислителя или восстановителя в электрохимических реакциях, что позволяет использовать его в разработке новых электродных материалов и устройств. Кроме того, данный процесс обладает потенциалом для создания новых сенсоров и датчиков на основе металлических материалов с участием оксида азота.
Выводя нас к окончанию, можно отметить, что взаимодействие оксида азота с металлами представляет собой важную область исследований и имеет множество потенциальных приложений. Понимание особенностей этого взаимодействия позволяет разрабатывать новые материалы и технологии, а также обогащает наше понимание основ химии и физики металлов.
Химические свойства оксида азота
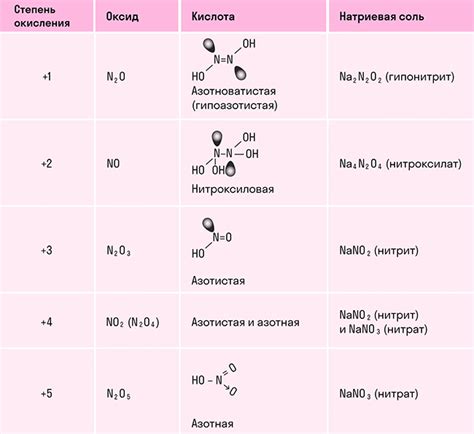
Оксид азота, известный также как азотная кислота (NO), является одним из самых известных и широко используемых газообразных соединений в химии. Соединение обладает рядом уникальных химических свойств, которые делают его важным в различных промышленных и научных областях.
Оксид азота является газообразным соединением с едким запахом. Он обладает высокой реакционной активностью и способен вступать в химические реакции с различными веществами. Особенно важной характеристикой оксида азота является его способность окисляться и восстанавливаться в различных химических реакциях.
Оксид азота широко применяется в различных отраслях промышленности. Благодаря своей реакционной активности, он используется в качестве окислителя и катализатора в производстве различных органических соединений, включая фармацевтические препараты и пластмассы.
Также оксид азота играет важную роль в медицине. Он используется в качестве сигнального молекулярного мессенджера в организме человека и участвует в регуляции многих физиологических процессов, таких как сужение и расширение кровеносных сосудов.
Оксид азота также является главным источником загрязнения воздуха в ближнем окружении. Это связано с его ролью в образовании смога и преобразовании вредных веществ в атмосфере. Поэтому контроль над выбросами оксида азота является одной из важных задач экологии и охраны окружающей среды.
Реакция оксида азота с металлами

Оксид азота (NO) обладает способностью взаимодействовать с различными металлами и образовывать соединения с ними. Эта реакция может протекать в различных условиях, включая высокие температуры и атмосферные условия.
При контакте оксида азота с металлами происходит образование нитридов, которые имеют важные промышленные и научные приложения. Нитриды обладают различными физическими и химическими свойствами, которые зависят от типа и структуры металла.
В зависимости от условий реакции, оксид азота может образовать нитриды с различными стехиометрическими соотношениями. Некоторые металлы могут образовывать несколько типов нитридов в зависимости от концентрации оксида азота и температуры.
Реакция оксида азота с металлами находит применение в различных областях науки и промышленности. Например, некоторые нитриды используются в качестве катализаторов для различных химических процессов. Кроме того, нитриды могут быть использованы в производстве сплавов, покрытий и электронных материалов.
Формирование оксидов металлов
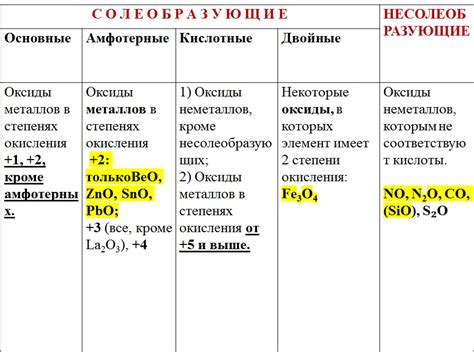
Оксиды металлов являются одним из самых распространенных классов химических соединений, их образование в значительной степени обусловлено взаимодействием металлов с кислородом. В процессе взаимодействия металлов с кислородом происходит окисление, в результате которого образуются соединения, содержащие кислород и металл, то есть оксиды металлов.
Формирование оксидов металлов может происходить как при стандартных условиях, так и при воздействии высоких температур или сильных окислительных сред. В результате окисления металлов могут образовываться различные оксиды, например, металлический никель может образовывать оксиды NiO, Ni2O3, NiO2 в зависимости от условий реакции.
Образование оксидов металлов имеет важное практическое значение. Например, оксиды металлов используются в качестве катализаторов в химических реакциях, а также в производстве пигментов, стекол, электродов и других материалов. Оксиды металлов могут также обладать различными физическими и химическими свойствами, что позволяет использовать их в различных областях промышленности и науки.
Применение оксида азота в металлургии

Оксид азота (NO) является важным веществом, применяемым в металлургической промышленности. Его использование основано на его свойствах и реакционной способности с металлами.
Одним из основных видов применения оксида азота является его использование в качестве катализатора при процессе нитрирования. Этот процесс заключается в введении азота в поверхностный слой металла, что приводит к повышению его твердости и улучшению других характеристик металла. Катализатором в этом процессе выступает оксид азота, который обеспечивает активацию азота и его взаимодействие с металлом.
Оксид азота также применяется в качестве средства для удаления оксида углерода (CO) или водорода (H2) из газовых смесей. Взаимодействие оксида азота с CO или H2 приводит к образованию устойчивых соединений, которые легко отделяются. Этот процесс используется для очистки газов от вредных примесей.
Кроме того, оксид азота используется для проведения процесса окисления металлов. Взаимодействие NO с поверхностью металла приводит к образованию окисленного слоя, который защищает металл от дальнейшей коррозии и повышает его стабильность. Этот процесс особенно важен для активных металлов, таких как алюминий и титан.
Таким образом, оксид азота находит широкое применение в металлургии, обеспечивая проведение различных процессов переработки металлов и улучшение их характеристик. Его реакционная способность и уникальные свойства делают его ценным инструментом в данной отрасли.
Использование оксида азота в каталитических процессах

Оксид азота (NO) используется в каталитических процессах благодаря своим уникальным химическим свойствам. Он является сложным окислителем и реагентом, способным участвовать во многих реакциях, включая окисление и редукцию различных соединений.
Одним из наиболее известных применений оксида азота является его использование в каталитическом синтезе аммиака при производстве удобрений. В этом процессе оксид азота используется в качестве катализатора для превращения азота и водорода в аммиак. Каталитический синтез аммиака является одним из ключевых процессов в химической промышленности.
Использование оксида азота также широко распространено в каталитической очистке отработавших газов. Он может использоваться для улавливания и преобразования вредных соединений, таких как оксиды азота, в более безопасные и менее вредные вещества. Каталитическая очистка отработавших газов играет важную роль в уменьшении выбросов вредных веществ в атмосферу и поддержании экологической безопасности.
Кроме того, оксид азота можно использовать в каталитических процессах для получения нитратов различных металлов. Он может служить катализатором при окислении металлов в специальных реакциях, что позволяет получать высококачественные нитратные соединения.
В заключение, использование оксида азота в каталитических процессах имеет широкий спектр приложений, включая производство удобрений, очистку отработавших газов и получение нитратов металлов. Уникальные химические свойства оксида азота делают его важным инструментом в современной химической промышленности и экологической технологии.
Вопрос-ответ

Что такое оксид азота?
Оксид азота - это соединение азота с кислородом. Существует несколько различных оксидов азота, но наиболее известные из них - это оксид азота (II) и оксид азота (III).
Какие особенности взаимодействия оксида азота с металлами?
Оксид азота является весьма реакционной и коррозионно-активной веществом, поэтому при взаимодействии с металлами может приводить к их окислению и коррозии. Однако, в некоторых случаях, оксид азота может также служить защитным покрытием для металлов и использоваться в качестве антикоррозионного средства.
Какие применения может иметь взаимодействие оксида азота с металлами?
Взаимодействие оксида азота с металлами может применяться в различных областях. Например, оксид азота может использоваться в процессах катализа, при производстве энергии и в электронике. Также, взаимодействие оксида азота с металлами может играть важную роль в химической промышленности, в процессах очистки воды и воздуха от загрязнений.
Какие металлы имеют наибольшую реакцию с оксидом азота?
Реакция оксида азота с металлами зависит от конкретного металла. Некоторые металлы, такие как железо и медь, могут проявлять высокую активность при взаимодействии с оксидом азота и могут быть подвержены коррозии. В то же время, другие металлы, например, золото и платина, являются менее реакционными и мало влияют на оксид азота.
