Сера – это химический элемент, принадлежащий к группе неметаллов, который находит множество применений в различных отраслях промышленности. Серная кислота – одно из самых важных химических соединений, которое широко используется в растворах различной концентрации. При взаимодействии металлов с разбавленной серной кислотой происходят реакции, в результате которых образуются новые соединения.
Реакции металлов с серной кислотой представляют собой классический пример замещения в химии. Когда металл взаимодействует с серной кислотой, идет обмен ионами, при котором металл замещает водород в кислоте. При этом образуются соли и высвобождается водород. Такие реакции широко используются в промышленности для получения различных соединений и очистки металлов.
Реакции разбавленной серной кислоты с разными металлами проходят с разной интенсивностью и скоростью. В некоторых случаях реакции сопровождаются выделением большого количества тепла или газов, что может привести к вспышкам, пожарам или взрывам. Поэтому технические меры безопасности и контроля очень важны при проведении таких реакций.
Как происходят реакции металлов с разбавленной серной кислотой?
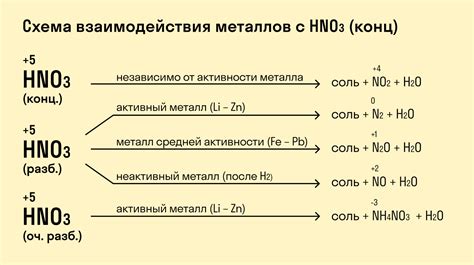
Взаимодействие металлов с разбавленной серной кислотой является химической реакцией, в результате которой образуются новые соединения. Реакция протекает по типу одновременной окислительно-восстановительной реакции, где металл подвергается окислению, а серная кислота - восстановлению.
При контакте с металлами, разбавленная серная кислота диссоциирует на ионы водорода (H+) и сульфатные ионы (SO4²⁻). Металл, в свою очередь, способен вступать в реакцию с ионами водорода, образуя водородный газ (H2) и соединение металла с сульфатными ионами.
Скорость реакции металла с разбавленной серной кислотой зависит от его активности. Наиболее активные металлы, такие как натрий (Na) или калий (K), реагируют очень интенсивно, выделяя большое количество водородного газа и прогревая раствор кислоты. Более инертные металлы, например, медь (Cu) или серебро (Ag), реагируют гораздо медленнее и образуют меньше водорода.
Образующийся водородный газ проявляет свои характерные свойства. Он обладает легкостью и возгоняемостью, поэтому при реакции металлов с серной кислотой в растворе можно наблюдать выделение пузырьков газа. При миломых условиях газ может проявлять возгоняемость и избытком состава вытеснять воздух, поэтому реакцию рекомендуется проводить в закрытых сосудах или под капотом химического шкафа.
Металлы и серная кислота: суть взаимодействия

Взаимодействие металлов с разбавленной серной кислотой является одним из классических примеров химической реакции. В результате этого взаимодействия образуются новые соединения и происходят химические превращения.
Когда металл вступает в контакт с разбавленной серной кислотой, происходит образование водорода и соли соответствующего металла. Это происходит благодаря реакции металла с серной кислотой, в результате которой выделяется газовый водород и образуется соль, также известная как сульфат металла.
Взаимодействие металлов с серной кислотой обусловлено их химическими свойствами. Многие металлы, особенно активные металлы, имеют способность вступать в реакцию с кислотами, в том числе и с серной кислотой. Это связано с их способностью отдавать электроны и образовывать положительно заряженные ионы.
Реакции металлов с серной кислотой позволяют получать важные промышленные продукты и используются в различных сферах. Например, этот процесс может быть использован для производства сульфата меди, который широко применяется в производстве медных изделий и в сельском хозяйстве в качестве удобрения.
Образование сульфатов
Сульфаты - это соединения, образующиеся в результате реакции металлов с разбавленной серной кислотой. При этой реакции происходит образование новых веществ и выделение газа.
Металлы активной группы, такие как цинк, железо, медь, никель и свинец, реагируют с серной кислотой, образуя соответствующие сульфаты. Например, при реакции цинка с серной кислотой образуется сульфат цинка (ZnSO4).
Реакция проводится путем добавления разбавленной серной кислоты к металлу. Во время реакции температура может повышаться, а раствор может менять цвет и становиться мутным.
Продукты реакции, сульфаты, обладают различными физическими и химическими свойствами. Они имеют множество применений в различных отраслях промышленности, медицине и сельском хозяйстве.
Выводы:
- Реакция металлов с разбавленной серной кислотой приводит к образованию сульфатов.
- Сульфаты обладают различными свойствами и имеют множество применений.
- Реакция металла с серной кислотой может сопровождаться изменением температуры и окрашиванием раствора.
Выделение водорода
При взаимодействии металлов с разбавленной серной кислотой происходит выделение водорода.
- Выделение водорода – один из основных признаков реакции металлов с кислотами, в том числе с серной кислотой.
- Водород выделяется в виде пузырьков и образует газообразную фазу реакционной среды.
- Выделение водорода происходит при разбавлении серной кислоты водой, что позволяет уменьшить концентрацию кислоты и повысить безопасность процесса.
- Данный процесс называется химической реакцией восстановления, так как металлы в реакции окисляются, а водород восстанавливается.
Выделение водорода можно определить с помощью реакции с серой, при которой образуется сероводород:
- Газообразный водород, выделяющийся в результате реакции, смешивается с прошедшими через колбу паровыми флюидами.
- В результате реакции водорода с серой образуется сероводород, который имеет характерный запах гнилых яиц.
- Образование сероводорода является подтверждением того, что в реакции с серной кислотой происходит выделение водорода.
- Образовавшийся сероводород можно обнаружить, приложив к колбе с газом следующую реакционную ленту, окрашенную влагой перманганатом калия.
Таким образом, выделение водорода при реакции металлов с разбавленной серной кислотой является важным процессом, позволяющим определить химическую активность металлов и исследовать их свойства.
Восстановление серной кислоты
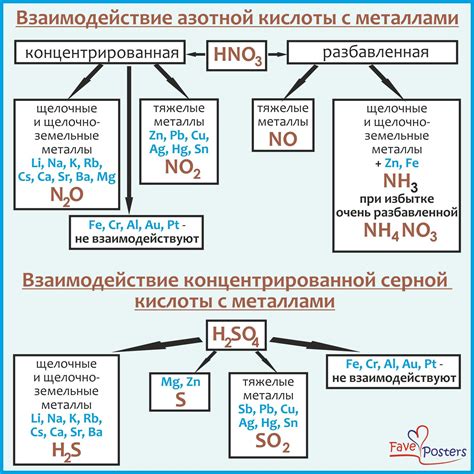
В процессе реакций металлов с разбавленной серной кислотой, одним из возможных продуктов является сероводород (H2S). Это происходит при восстановлении серной кислоты металлами.
Восстановление – это процесс, при котором некоторая химическая реакция приводит к увеличению степени окисления вещества. В случае с серной кислотой, эта реакция протекает таким образом, что гидрогенная кислота превращается в сероводород и другие продукты.
Восстановление серной кислоты может быть описано следующим образом:
- Сначала металл реагирует с серной кислотой, образуя соль металла и выделяя водород:
- 2M + H2SO4 → MSO4 + H2
- H2SO4 + H2 → H2S + H2O
Таким образом, в результате восстановления серной кислоты получается сероводород, который может выделяться в виде газа. Эта реакция имеет большое практическое значение, так как сероводород широко используется в различных отраслях промышленности и химии.
Особенности реакций различных металлов

1. Алюминий: Реакция металла с разбавленной серной кислотой приводит к образованию сульфата алюминия и выделению гидрогена. Реакция протекает с выделением тепла и сопровождается плавающими пузырьками газа.
2. Цинк: Реакция цинка с разбавленной серной кислотой приводит к образованию сульфата цинка и выделению гидрогена. При этом можно наблюдать появление пузырьков газа и постепенное растворение металла.
3. Медь: Реакция меди с разбавленной серной кислотой происходит медленно и неоднородно. При этом образуется сульфат меди и выделяется газовый продукт. Реакция протекает с выделением тепла.
4. Железо: Реакция железа с разбавленной серной кислотой приводит к образованию сульфата железа и высвобождению гидрогена. Эта реакция может протекать довольно активно и с выделением тепла.
5. Свинец: Реакция свинца с разбавленной серной кислотой протекает медленно и неоднородно. Образуется сульфат свинца, который будет оседать на поверхности металла. Выделения газа при этой реакции не наблюдается.
6. Аргентум (серебро): Реакция серебра с разбавленной серной кислотой происходит с выделением малого количества газа и образованием сульфата серебра. Реакция медленная и не сопровождается выделением тепла.
7. Магний: Реакция магния с разбавленной серной кислотой протекает быстро и ярко. При реакции образуется сульфат магния и газовый продукт, что сопровождается выделением тепла и яркими вспышками света.
8. Сталь: Реакция стали с разбавленной серной кислотой приводит к образованию сульфата железа и выделению газа. При этом сталь может проявлять поверхностную коррозию.
9. Никель: Реакция никеля с разбавленной серной кислотой протекает медленно и неоднородно. Формируется сульфат никеля и выделяется газ. Реакция может быть сопровождена выделением тепла.
Использование полученных соединений
Сульфаты металлов – важные промышленные продукты
Сульфаты металлов, образованные в результате реакции металлов с разбавленной серной кислотой, широко используются в различных отраслях промышленности. Одним из наиболее распространенных применений является использование сульфатов металлов в производстве минеральных удобрений. Например, сульфат цинка используется как добавка в удобрениях для улучшения роста растений.
Как катализаторы в химических реакциях
Некоторые соединения, полученные при реакции металлов с разбавленной серной кислотой, могут быть использованы в качестве катализаторов в химических реакциях. Катализаторы ускоряют химические процессы, не участвуя в них сами. Например, некоторые соединения меди, такие как сульфат меди, используются в качестве катализаторов при осаждении металлов на различных поверхностях.
В производстве электрических элементов
Полученные соединения также могут быть использованы в производстве электрических элементов. Например, сульфат никеля используется в производстве никель-кадмиевых аккумуляторов. Сульфиды металлов, полученные в результате обработки металлов серной кислотой, можно использовать в производстве солнечных элементов.
В фармацевтической и косметической промышленности
Некоторые соединения металлов, полученные при реакции с разбавленной серной кислотой, находят применение в фармацевтической и косметической промышленности. Например, сульфат магния используется в качестве лечебного препарата при различных заболеваниях. Серебро, полученное в результате реакции, может быть использовано в производстве косметических средств с антимикробными свойствами.
Состав и свойства сульфатов

Сульфаты – это соли серной кислоты (H2SO4) с положительными ионами различных металлов. Они обладают характерными свойствами, которые определяются структурой и составом этих соединений.
Сульфаты обычно являются белыми кристаллическими веществами, растворимыми в воде. Некоторые сульфаты имеют ярко выраженный цвет, что связано с наличием в их составе переходных металлов. Например, сульфат железа(II) имеет зеленоватый цвет, а сульфат меди(II) – голубой цвет.
Вода является единственным растворителем, в котором сульфаты хорошо растворимы. В растворе сульфаты ионизируются на положительно заряженные металлические ионы и отрицательно заряженные сульфатные (SO4) ионы. В то же время, сульфаты могут образовать химические соединения с другими растворимыми солями, называемыми сульфатными двойными солями.
Некоторые сульфаты обладают интересными свойствами. Например, сульфат магния (MgSO4) широко используется в медицине и сельском хозяйстве. Он обладает способностью изменять скорость химических реакций и применяется в качестве подкислителя и удобрения. Сульфат алюминия (Al2(SO4)3) используется в производстве бумаги, красок и металлов. Бариевый сульфат (BaSO4) применяется в медицине как контрастное вещество при рентгенологических исследованиях.
Вопрос-ответ

Какие металлы реагируют с разбавленной серной кислотой?
Реагировать с разбавленной серной кислотой могут многие металлы, такие как железо, цинк, алюминий, медь и т. д.
Что происходит при реакции металлов с разбавленной серной кислотой?
При реакции металлов с разбавленной серной кислотой происходит образование новых соединений и выделение водорода.
Какие продукты образуются при реакции металлов с разбавленной серной кислотой?
При реакции металлов с разбавленной серной кислотой образуются соединения, такие как сульфаты металлов, а в результате выделяется водородный газ.
Какая роль играет разбавленная серная кислота при взаимодействии с металлами?
Разбавленная серная кислота является активным окислителем и при контакте с металлами приводит к их окислению и образованию соответствующих сульфатов.
