Металлы - это химические элементы, которые способны образовывать ионы с положительным зарядом. Они обладают высокой проводимостью электрического тока, благодаря чему широко применяются в различных отраслях промышленности и научных исследованиях. При контакте с растворимыми основаниями металлы могут проявлять разнообразные реакции, в зависимости от их химических свойств и условий проведения эксперимента.
Одним из примеров реакции металлов с растворимыми основаниями является реакция алюминия с гидроксидом натрия. В результате этой реакции образуется соль алюминия и вода. За счет активности металла алюминий обладает способностью реагировать с водой, при этом выделяется водородный газ, который проявляет себя в виде характерной пены.
Кроме алюминия, с растворимыми основаниями реагируют и другие металлы, такие как натрий, калий, кальций и другие. Например, реакция натрия с гидроксидом натрия приводит к образованию соли натрия и водорода. При этом наблюдается яркое выделение тепла и света, что является одним из характерных признаков таких реакций.
Важно отметить, что реакция металлов с растворимыми основаниями протекает с образованием большого количества теплоты. Это связано с высокой активностью металлов, которая является ключевым фактором в процессе.
Одной из особенностей таких реакций является их высокая степень экзотермичности. То есть, реакция сопровождается выделением значительного количества тепла. Именно поэтому при проведении данных экспериментов следует соблюдать меры предосторожности, такие как использование защитной экипировки и проведение реакции в специально оборудованной лаборатории.
Реакции металлов с растворимыми основаниями являются важным объектом изучения в химии. Они позволяют понять химические свойства металлов и применить их в практических целях. Такие реакции находят свое применение в различных отраслях промышленности, а также в научных исследованиях и создании новых материалов.
Определение растворимых оснований

Растворимые основания – это химические соединения, которые в растворе образуют отрицательно заряженные ионы гидроксида (OH-). Они выступают в качестве активных компонентов в различных процессах протекания реакций растворения, нейтрализации и осаждения.
Растворимые основания могут быть минеральными или органическими соединениями, которые обладают высокой растворимостью в воде. Они имеют способность формировать щелочные растворы с кислотными свойствами. Примерами растворимых оснований являются NaOH (натриевая гидроксид), KOH (калиевая гидроксид), Ca(OH)2 (гидроксид кальция) и другие.
Определение растворимых оснований осуществляется с помощью различных методов и экспериментов в химической лаборатории. Одним из таких методов является измерение pH-уровня раствора с помощью pH-метра. Если pH-уровень превышает 7, то раствор считается щелочным и содержит растворимое основание.
Растворимые основания широко применяются в различных сферах, включая промышленность, медицину и химическую науку. Они используются для нейтрализации кислот, регулирования pH-уровня, очистки и обработки воды, а также в производстве различных химических соединений.
Как реагируют металлы с растворимыми основаниями?

Реакция металлов с растворимыми основаниями - это химическая реакция, в результате которой образуется соль и выделяется водород. Основания, в данном случае, представляют собой вещества, которые содержат гидроксильные группы (OH-) и способны отдавать ионы гидроксида. Металлы, в свою очередь, проявляют активность в своей химической активности.
При взаимодействии металлов с растворимыми основаниями происходит замещение ионов металла в основании на ионы металла реакцию. Данная реакция протекает в следующем виде:
- Металл + растворимое основание = соль + водород
Например, при взаимодействии цинка с гидроксидом натрия образуется соль - гидроксид цинка (Zn(OH)2) и выделяется водород. Эта реакция можно записать следующим образом:
Zn + 2NaOH = Zn(OH)2 + H2
В итоге получается соль, которая остается в растворе, и молекулы водорода, которые выделяются в виде пузырьков.
Реакция металлов с растворимыми основаниями часто сопровождается выделением тепла и характерными свойствами металла. Например, при взаимодействии кальция с гидроксидом натрия выделяется большое количество тепла, а также образуется соль - гидроксид кальция (Ca(OH)2).
Примеры реакций металлов с растворимыми основаниями
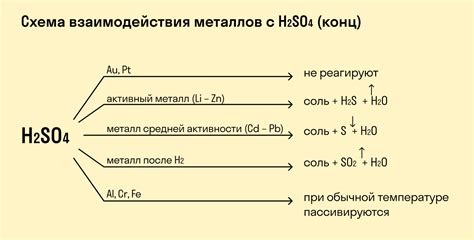
Реакция металлов с растворимыми основаниями – это процесс, при котором металл и основание взаимодействуют, образуя соль и выделяя водород. Чаще всего такие реакции происходят с щелочами и щелочно-земельными металлами или их гидроксидами.
Наибольшую активность в этом виде реакций проявляют щелочные металлы, такие как натрий, калий, цезий. Например, при взаимодействии натрия с растворимыми основаниями, такими как гидроксид натрия, образуется соль – натрийхлорид, и выделяется водородный газ:
2Na + 2NaOH → 2NaCl + H2O
Также реакции возможны с щелочно-земельными металлами, такими как магний, кальций, барий. Например, реакция магния с гидроксидом натрия приводит к образованию соли – магнийхлорида, и выделению водорода:
Mg + 2NaOH → MgCl2 + H2O
Особенностью реакций металлов с растворимыми основаниями является выделение водорода. Это объясняется тем, что металлы довольно активно вступают в реакцию с гидроксидами, образуя соответствующую соль. Водород же, являясь газом, выделяется в виде пузырьков и может быть обнаружен посредством различных методов, например, при помощи горения или образования шаров воздуха.
Особенности реакций различных металлов

Реакции металлов с растворимыми основаниями проходят с участием различных металлов и обладают своими особенностями.
Например, реакция цинка с растворимыми основаниями характеризуется выделением водорода и образованием соли цинка. Обычно цинк реагирует с основаниями внезапно, с выделением достаточно большого количества газа, что делает реакцию заметной.
Алюминий, в свою очередь, реагирует с основаниями с образованием алюминатов и выделением водорода. Реакция алюминия с основаниями проходит достаточно медленно, что позволяет контролировать скорость процесса.
Реакции железа с растворимыми основаниями имеют свою особенность - образование двухвалентных железных солей. При этом реакция протекает быстро и интенсивно, что можно наблюдать по изменению окраски раствора.
Медь, в отличие от предыдущих металлов, практически не реагирует с растворимыми основаниями при обычных условиях. Однако, при нагревании медь образует соответствующие соли и выделяет газообразные продукты.
Значительная часть реакций с металлами проходит с образованием водорода. Это связано с тем, что водород имеет высокую реакционную активность и может соединяться с металлами, образуя газообразные соединения.
В целом, реакции металлов с растворимыми основаниями имеют свои особенности в зависимости от металла, его свойств и условий реакции. Это позволяет изучать их в лабораторных условиях и применять в различных технологических процессах.
Катионы металлов в растворимых основаниях
Катионы металлов в растворимых основаниях – это положительно заряженные ионы металлов, которые образуются при реакции металла с основанием. Основания могут быть представлены различными соединениями, например, гидроксидами металлов.
Когда металл вступает в реакцию с растворимым основанием, образуется соль и водород. Катионы металла, находящегося в реакции, переходят в раствор и образуют растворимые соединения. Например, при реакции натрия с гидроксидом натрия образуется соль натрия и вода.
Катионы металлов имеют разные свойства в растворимых основаниях. Они могут образовывать осмотически активные растворы, которые способны проявлять электролитные свойства и проводить электрический ток. Катионы металлов также могут образовывать нерастворимые основания, которые могут выпадать в виде осадка при реакции с кислотами или другими ионами.
Некоторые катионы металлов обладают свойством образовывать соединения с разными степенями окисления. Например, катионы меди могут образовывать соединения с двухвалентной и одновалентной медью. Это свойство металлов может быть использовано в химических реакциях и при синтезе различных соединений.
Использование реакций металлов с растворимыми основаниями в промышленности

Реакции металлов с растворимыми основаниями широко используются в промышленности. Они применяются для получения различных продуктов и материалов, а также для производства энергии.
Одной из важных областей применения таких реакций является производство водорода. Металлы, такие как алюминий и литий, могут реагировать с водой или растворимыми основаниями, освобождая при этом газообразный водород. Этот процесс является эффективным и надежным способом получения водорода, который широко используется в промышленности, в том числе для производства аммиака и метилового спирта.
Еще одним важным применением реакций металлов с растворимыми основаниями является получение электроэнергии. Металлы, такие как натрий, калий и цезий, могут реагировать с водой с выделением энергии. Эта реакция может быть использована для получения электрической энергии в специальных установках, называемых гальванопреобразователями. Такие установки используются в солнечных электростанциях и других источниках возобновляемой энергии.
Кроме того, реакции металлов с растворимыми основаниями используются для получения различных металлических соединений. Например, реакция цинка с гидроксидом калия приводит к образованию гидроксида цинка, который используется в производстве керамики и других материалов. Также реакция никеля с гидроксидом натрия может привести к образованию гидроксида никеля, который используется в производстве батарей.
Таким образом, реакции металлов с растворимыми основаниями находят широкое применение в промышленности и играют важную роль в производстве различных продуктов и материалов, а также в получении электроэнергии. Эти реакции позволяют эффективно использовать свойства металлов и оснований, что делает их незаменимыми инструментами в различных отраслях промышленности.
Выводы

В результате проведенных экспериментов можно сделать следующие выводы:
- Реакция металлов с растворимыми основаниями осуществляется путем образования гидроксидов металлов и выделения водорода.
- Скорость реакции зависит от реакционной способности металла. Металлы с большей реакционной способностью (например, щелочные металлы) реагируют быстрее.
- Растворимые основания могут быть как кислотными гидроксидами (например, гидроксидом серы), так и щелочными гидроксидами (например, гидроксидом натрия).
- Реакция металла с растворимым основанием сопровождается выделением газа (водорода) и изменением температуры реакционной смеси. При этом скорость и интенсивность выделения водорода могут отличаться в зависимости от свойств металла и основания.
- Полученные гидроксиды металлов являются основаниями и могут использоваться в различных химических процессах, например, в производстве удобрений, полимеров и других веществ.
Исходя из вышеизложенных фактов, следует отметить, что реакции металлов с растворимыми основаниями являются важным объектом изучения в области химии и имеют широкий спектр применений в промышленности и научных исследованиях.
Вопрос-ответ

Какие металлы реагируют с растворимыми основаниями?
Многие металлы могут реагировать с растворимыми основаниями, включая щелочные и щелочноземельные металлы, такие как натрий, калий, магний и кальций. Также некоторые тяжелые металлы, включая алюминий и цинк, могут реагировать с основаниями.
Какая реакция происходит при взаимодействии металлов с растворимыми основаниями?
Во время реакции между металлом и растворимым основанием образуется соль и выделяется водород. Например, при взаимодействии натрия с водой образуется гидроксид натрия и выделяется водородный газ.
Какие особенности имеют реакции металлов с растворимыми основаниями?
Реакции металлов с растворимыми основаниями могут протекать очень быстро и обычно сопровождаются выделением большого количества тепла и газа. Некоторые металлы, такие как натрий и калий, реагируют с водой очень активно и даже могут вызывать вспышки или пожары.
