Металлы – это особый класс элементов, характеризующийся своеобразными свойствами и способностью вступать в химические реакции с различными веществами. Растворы солей металлов представляют собой одно из таких веществ, с которыми металлы могут вступать в разнообразные реакции. Данные реакции характеризуются определенными особенностями и могут приводить к образованию новых соединений.
Одной из основных особенностей реакций металлов с растворами солей других металлов является способность металла замещать другой металл в соединении. Данный процесс называется замещением или реакцией замещения. В результате такой реакции происходит передача электронов от активного металла к иону другого металла, что приводит к образованию нового соединения.
Примером реакции металлов с растворами солей других металлов является реакция железа с раствором серной кислоты и меди. Железо, как более активный металл, замещает медь в ее соли, образуя сернокислое железо и выделение медного металла. Полученная реакция имеет следующую формулу: Fe + CuSO4 = FeSO4 + Cu.
Таким образом, реакции металлов с растворами солей других металлов представляют особую форму химических превращений, для которых характерно замещение одного металла другим. Данные реакции находят широкое применение в различных отраслях промышленности и электротехнике. Они являются основой процессов гальваностегии, в которых осуществляется покрытие одного металла другим, а также являются важными для понимания химических свойств металлов.
Основные принципы реакций металлов с растворами солей

Реакции металлов с растворами солей представляют собой важные процессы, которые основываются на химическом взаимодействии между металлами и ионами в растворе. Эти реакции могут быть использованы для получения новых соединений, а также индикации наличия определенных металлов в растворе.
Одним из основных принципов реакций металлов с растворами солей является замещение. Когда металл вступает в реакцию с раствором соли другого металла, ионы металла в растворе замещаются ионами металла, вступающего в реакцию. Например, когда медь вступает в реакцию с раствором железных солей, медные ионы замещают железные ионы в растворе, образуя новое соединение.
Важным аспектом реакций металлов с растворами солей является электрохимический характер этих процессов. Металлы могут вступать в реакцию как восстановители или окислители, обратимо передавая электроны. Некоторые металлы, такие как литий или системы алюминий-цинк, обладают высокой активностью и способны восстанавливать ионы других металлов в растворе. Это электрохимическое взаимодействие позволяет использовать реакции металлов с растворами солей в различных технических и промышленных процессах.
- Примером реакции металла с раствором соли является взаимодействие алюминия с раствором медного(II) купрати. В результате реакции алюминий замещает медь в растворе и образуется алюминийсодержащее соединение, а медь осаждается на поверхности алюминия.
- Другим примером реакции металла с раствором соли является взаимодействие цинка с раствором железного(II) сульфата. В этом случае цинк замещает железо в растворе, образуя новое соединение, а железо при этом осаждается в виде отдельных частиц.
Таким образом, реакции металлов с растворами солей основаны на принципах замещения и электрохимического взаимодействия. Эти реакции имеют широкое применение в химической промышленности и аналитической химии, и являются важными процессами для получения новых соединений и определения наличия определенных металлов в растворе.
Реакции металлов: теоретический обзор

Металлы - вещества, обладающие способностью проводить тепло и электричество. Одной из основных свойств металлов является их способность к реакциям с другими веществами, включая растворы солей других металлов.
Реакции металлов с растворами солей происходят по принципу обмена ионами. В процессе реакции ионы металла, находящегося в металлической форме, вступают в реакцию с ионами металла из раствора соли. В результате образуются новые соединения, часто выделяющиеся в виде осадка или изменения цвета раствора.
Реакции металлов с растворами солей могут проходить с различной интенсивностью. Некоторые металлы, такие как цинк или железо, обладают высокой активностью и способны вытеснять ионы менее активных металлов из их солей. Это наблюдается, например, при реакции цинка с раствором медного купороса, когда медные ионы образуют медный осадок, а цинк растворяется.
Реакции металлов с растворами солей имеют множество практических применений. Так, например, осаждение металлов из растворов солей используется в химическом производстве для получения чистых соединений металлов или их сплавов. Также эти реакции широко применяются в аналитической химии для определения наличия и количества определенных металлов в растворе.
Роли металлов в реакциях с растворами солей

Металлы играют важную роль в реакциях с растворами солей других металлов. Они могут быть реагентами или продуктами данных химических превращений.
Реагентное металл может быть использован для выделения металла из его соли. Например, добавление цинка (Zn) в раствор медной соли приведет к образованию меди (Cu) и осаждению цинка. Это реакция замещения, где более активный метал (цинк) вытесняет менее активный (медь) из его соли.
Металлы также могут быть продуктами реакций с растворами солей. Например, взаимодействие меди (Cu) с раствором серебряной соли приводит к образованию серебра (Ag) и выпадению меди. Такая реакция замещения позволяет получать чистые металлы из их солей.
Некоторые металлы имеют способность образовывать комплексные соединения с растворимыми солями других металлов. Например, железо (Fe) может образовывать комплексы с аммиаком (NH3) в растворах солей других металлов. Это свойство используется в аналитической химии для определения наличия определенных металлов в растворах.
Также металлы могут выполнять структурную роль в реакциях с растворами солей. Например, при взаимодействии раствора никелевой соли с алюминием (Al), атомы никеля могут встроиться в кристаллическую решетку алюминия, что приводит к формированию сплавного материала.
Исследование реакций металлов с растворами солей других металлов позволяет расширить наше понимание процессов в химии и применение металлов в различных областях, таких как производство металлов, нанотехнологии и аналитическая химия.
Особенности реакций металлов с растворами солей

Реакции металлов с растворами солей представляют собой химические процессы, при которых происходит обмен элементов между металлами. В результате таких реакций образуются новые соединения, и проявляются характерные свойства металлов.
Одной из особенностей реакций металлов с растворами солей является возможность замещения одного металла другим. Это происходит, когда активность одного металла выше активности другого. Например, металл, который находится ниже в ряду активности, замещает металл, который находится выше. Такая реакция называется замещающей или реакцией дисплейсмента.
Другой особенностью реакций металлов с растворами солей является образование осадков при взаимодействии металла с раствором соли. Это происходит, когда образуется не растворимое соединение между металлом и анионом соли. Например, при взаимодействии цинка и раствора медного(II)сульфата, образуется осадок меди.
Еще одной особенностью реакций металлов с растворами солей является изменение окраски раствора. Изначально раствор соли может иметь определенную окраску, однако после взаимодействия с металлом окраска может измениться. Например, раствор железного(III)хлорида имеет желто-коричневую окраску, но при реакции с цинком окраска становится безцветной.
Таким образом, реакции металлов с растворами солей имеют несколько особенностей, включая замещение одного металла другим, образование осадков и изменение окраски раствора. Эти особенности играют важную роль в химии и позволяют углубить наше понимание химических процессов.
Клинтоновый процесс
Клинтоновый процесс – это тип реакции металлов с растворами солей других металлов, который был назван в честь американского ученого Фредерика Клинтона. Данный процесс характеризуется осаждением более дорогого металла на поверхности менее дорогого металла.
Одним из примеров клинтонового процесса является реакция цинка с раствором меди(II)сульфата. В результате этой реакции на поверхности цинка осаждаются атомы меди, а цинк переходит в раствор. Эта реакция может быть представлена следующим уравнением: Zn + CuSO4 → ZnSO4 + Cu.
Принцип клинтонового процесса лежит в том, что разность электрохимических потенциалов между двумя металлами создает электрический ток, который обеспечивает перенос ионов из раствора на поверхность металла. При этом возникает разность в переносимом заряде, что приводит к образованию более дорогого металла на поверхности менее дорогого металла.
Клинтоновый процесс находит применение в различных областях, включая гальваническое покрытие металлами и электрохимическое синтезирование соединений. Этот процесс позволяет получать покрытия с желаемыми физическими и химическими свойствами, а также обеспечивает возможность контролировать толщину и качество покрытий.
Гальваническая коррозия
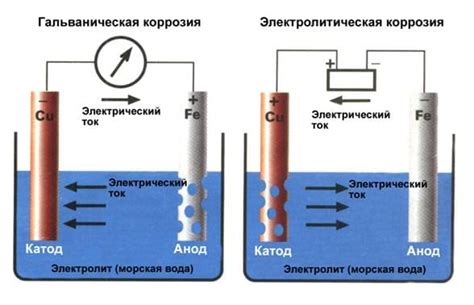
Гальваническая коррозия – это электрохимический процесс, возникающий при контакте двух разнородных металлов в среде, содержащей электролит. При гальванической коррозии один металл выступает в роли анода и подвергается разрушению, а другой металл выступает в роли катода и остается относительно неповрежденным.
Этот процесс основан на разнице потенциалов между металлами. Когда разные металлы находятся в контакте, создается электролитическая реакционная цепь. Окисление и восстановление происходят на разных металлах, в результате чего происходит передача электронов из анода на катод.
Важным аспектом гальванической коррозии является присутствие электролита, который участвует в реакциях. Электролит может быть раствором солей или влажной средой, которая содержит ионы, способные проводить электрический ток.
Гальваническая коррозия может привести к серьезным повреждениям и разрушению металлических конструкций или изделий. Для предотвращения гальванической коррозии могут использоваться специальные меры, такие как использование защитных покрытий или анодной защиты. Также важно учитывать совместимость различных металлов при проектировании и сборке металлических конструкций, чтобы минимизировать риск гальванической коррозии.
Примеры реакций металлов с растворами солей

Реакции металлов с растворами солей представляют собой взаимодействие активного металла с ионами другого металла в растворе. Процесс характеризуется образованием нового соединения и сопровождается изменением окраски раствора, образованием газов или выпадением осадка.
Один из примеров реакции металла с раствором соли - реакция железа Fe с раствором сернокислого меди (II) CuSO4. При взаимодействии железа с ионами меди в растворе происходит реакция окислительно-восстановительного по типу:
- Fe(s) + CuSO4(aq) → FeSO4(aq) + Cu(s)
В результате реакции медь выделяется на поверхности железа, а железо переходит в ионное состояние, образуя сернокислое железо(II).
Другим примером реакции металла с раствором соли является реакция магния Mg с раствором серной кислоты H2SO4. Магний обладает бо́льшей химической активностью, чем водород, поэтому дисплейная мысль: Mg(s) + H2SO4(aq) → MgSO4(aq) + H2(g)
При этом образуется сернокислый магний(II) и выделяется молекулярный водород. Процесс сопровождается характерной реакцией: выделение газовой пузырьков на поверхности металла.
Реакция алюминия с раствором медного купороса
Алюминий обладает высокой химической активностью, и его реакция с растворами солей других металлов является интересным объектом исследования. Рассмотрим взаимодействие алюминия с раствором медного купороса (сульфата меди(II)).
При смешении алюминия и раствора медного купороса происходит химическая реакция, в результате которой алюминий вытесняет медь из ее соединения. Медь выделяется в виде медного осадка, а алюминий саморектируется и образует пассивную пленку его оксида на поверхности, защищающую его от дальнейшего взаимодействия с окружающей средой.
Полученный медный осадок обычно обладает характерным красным или оранжевым оттенком, что свидетельствует о присутствии ионов меди. Образование этого осадка можно наблюдать в процессе реакции.
Химическая реакция между алюминием и раствором медного купороса может быть описана следующим уравнением:
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
Реакция алюминия с раствором медного купороса является примером реакции обратного вытеснения, когда металл с большей электрохимической активностью (в данном случае алюминий) вытесняет металл с меньшей активностью (медь) из его соединения.
Этот эксперимент можно провести и в домашних условиях, используя алюминиевую фольгу и раствор медного купороса. Однако необходима осторожность, так как раствор медного купороса является химически активным и может вызвать ожоги при попадании на кожу. Реакцию следует проводить под присмотром взрослых и с соблюдением мер безопасности.
Вопрос-ответ

Что происходит при реакции металлов с растворами солей других металлов?
При реакции металлов с растворами солей других металлов происходит обмен ионами, в результате которого металл из первичного раствора присоединяется к металлу второго раствора, образуя осадок или растворяясь. Такие реакции особенно интересны в качестве способа получения новых, более ценных соединений.
Какие особенности характерны для реакций металлов с растворами солей других металлов?
Одной из особенностей реакций металлов с растворами солей других металлов является возможность образования осадков в виде нерастворимых соединений металлов. Кроме того, реакции также могут протекать с выделением газов или изменением окраски растворов. Однако, не все металлы способны реагировать между собой, так как реакция зависит от их активности и стабильности составляющих их ионов.
Можете привести примеры реакций металлов с растворами солей других металлов?
Конечно! Один из примеров реакции металлов с растворами солей других металлов это реакция цинка с раствором меди(II)сульфата, в результате которой цинк вытесняет медь из ее соединения и образуется осадок цинка. Еще одним примером может быть реакция железа с раствором серебро(II)нитрата, в результате которой образуется осадок серебра, а железо переходит в форму двухвалентного иона. Эти примеры демонстрируют различные химические свойства металлов и их способность к обмену ионами.
