Реакции простых веществ металлов являются основой многих процессов в химии и технологии. Они происходят между металлическими элементами и другими веществами, результатом которых является образование химических соединений. Важно понимать, что такие реакции могут происходить как в присутствии кислорода, так и без него.
Когда металл взаимодействует с кислородом, происходит окисление металла. В результате образуется оксид металла, который имеет свои уникальные свойства и может использоваться в различных отраслях промышленности. Например, оксид меди используется в производстве электроники, оксид железа является основой для производства стали.
Однако не все реакции простых веществ металлов происходят с кислородом. Некоторые металлы могут вступать в реакцию с кислотами, основаниями или солями. Например, реакция цинка и соляной кислоты приводит к образованию хлорида цинка и выделению водорода. Такие реакции часто используются в лабораторной практике для выделения и идентификации металлов.
Реакции простых веществ металлов являются важной частью химической науки и имеют практическое значение в различных областях человеческой деятельности. Изучение данных реакций позволяет разрабатывать новые материалы, оптимизировать производственные процессы и создавать инновационные технологии.
Роль металлов в химических реакциях

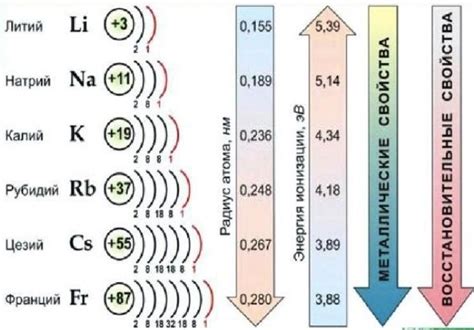
Металлы играют важную роль в химических реакциях благодаря своим особым свойствам и электронной структуре. Они способны образовывать ионы положительного заряда, которые легко вступают во взаимодействие с другими веществами.
Одно из основных свойств металлов - активность в реакциях с кислородом. Металлы, такие как натрий, калий, магний, реагируют с кислородом воздуха, образуя оксиды металлов. Например, натрий реагирует с кислородом, образуя оксид натрия.
Металлы также могут реагировать с водой. Активные металлы, такие как натрий и калий, реагируют с водой, образуя гидроксид металла и выделяя водород. Например, реакция натрия с водой приводит к образованию гидроксида натрия и выделению водорода.
Металлы также могут быть окисленными или восстановлеными в химических реакциях. Окисление металла - это процесс потери его электронов, а восстановление - процесс приобретения электронов. Например, железо может быть окислено кислородом в восстановительной реакции, образуя оксид железа.
В кристаллической решетке некоторых металлов обнаруживается наличие подвижных электронов. Это объясняет их способность проводить электрический ток. Металлические сплавы широко используются в электротехнике, так как способны работать как проводники электричества.
Таким образом, роль металлов в химических реакциях заключается в их способности взаимодействовать с другими веществами, образовывать ионы, реагировать с кислородом и водой, а также в проводимости электричества и участии в окислительно-восстановительных реакциях.
Химические реакции: основные принципы
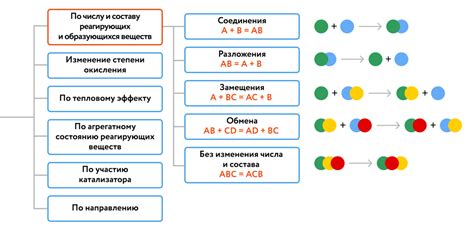
Химическая реакция - это процесс превращения одних веществ в другие, при котором происходит изменение их химического состава. Во время химической реакции происходит образование новых химических связей между атомами или ионами, а также разрывание уже существующих связей.
Принцип сохранения массы является одним из основных принципов химических реакций. Согласно этому принципу, во время химической реакции общая масса веществ до и после реакции остается неизменной. Это означает, что все атомы, присутствующие в реагентах, должны быть учтены при составлении уравнения реакции, чтобы обеспечить соблюдение принципа сохранения массы.
Реагенты - это вещества, которые участвуют в химической реакции, исчезая как самостоятельные соединения, но образуя новые вещества. Реагенты записываются на левой стороне уравнения реакции.
Продукты - это вещества, которые образуются в результате химической реакции. Они записываются на правой стороне уравнения реакции.
Уравнение химической реакции представляет собой запись всех реагентов и продуктов с указанием их соотношения. В уравнении химической реакции должен быть сохранен баланс - количество атомов каждого элемента до и после реакции должно быть одинаковым. Для достижения баланса массы атомов в уравнении используются коэффициенты перед формулами веществ.
Химические реакции могут протекать самопроизвольно, т.е. без внешнего воздействия, или с участием катализаторов, которые повышают скорость реакции. Некоторые реакции могут протекать с выделением или поглощением тепла, при этом окружающая среда может нагреваться или охлаждаться.
Химические реакции широко применяются в промышленности и научных исследованиях. Они позволяют получать новые вещества с заданными свойствами, осуществлять процессы очистки воды и воздуха, производить энергию и многое другое.
Взаимодействие металлов с кислородом

Взаимодействие металлов с кислородом является одним из фундаментальных процессов в химии. Кислород является активным элементом, который может взаимодействовать с металлами, приводя к образованию оксидов металлов.
Одной из наиболее известных реакций взаимодействия металлов с кислородом является окисление железа. При взаимодействии железа с кислородом образуется оксид железа, который обычно обозначается Fe2O3 и известен как ржавчина. Эта реакция является необратимой и происходит при обычных условиях.
Взаимодействие других металлов с кислородом также может привести к образованию оксидов. Например, при взаимодействии алюминия с кислородом образуется оксид алюминия (Al2O3), который обладает высокой теплостойкостью и используется в производстве огнеупорных материалов.
Взаимодействие металлов с кислородом может происходить не только в чистом виде, но и в составе различных соединений. Например, некоторые металлы могут реагировать с кислородом, содержащимся в воде или в воздухе. Это может привести к образованию оксидов металлов, которые часто являются основой для производства различных материалов и изделий.
Взаимодействие металлов с кислородом является фундаментальным процессом, который играет важную роль во многих отраслях промышленности и науки. Изучение и понимание этого процесса позволяет разрабатывать новые материалы и технологии, а также использовать их в различных сферах жизни.
Металлические сплавы и их влияние на химические реакции
Металлические сплавы представляют собой смесь двух или более металлов, а иногда и металлов с неметаллами. Они обладают особыми свойствами, которые могут оказывать влияние на химические реакции, в которых они участвуют.
Во-первых, металлические сплавы могут изменять скорость химических реакций. Внесение определенного металла в сплав может ускорить или замедлить протекание химической реакции, изменяя активность уже присутствующего металла.
Во-вторых, металлические сплавы могут изменять продукты химических реакций. Вспомним, что металлы могут образовать разные соединения с различными элементами. При наличии в сплаве двух или более металлов, реакции могут протекать иначе, образуя новые соединения или меняя состав уже существующих.
Некоторые металлические сплавы могут также влиять на стадии химических реакций. Они могут действовать как катализаторы, активируя или стабилизируя промежуточные состояния в реакционном протоколе, что может приводить к изменению скорости и направленности протекания реакции.
Таким образом, металлические сплавы имеют важное значение в химических реакциях, поскольку они могут внести изменения в скорость, продукты и механизмы реакций. Изучение и понимание их влияния является важной частью химии и материаловедения.
Вопрос-ответ

Какова роль простых веществ металлов в химических реакциях?
Простые вещества металлов играют важную роль в химических реакциях. Они обладают высокой химической активностью и могут взаимодействовать с различными веществами, образуя соединения и проявляя свои типичные химические свойства.
Как протекает реакция простого вещества металла с кислотой?
Реакция простого вещества металла с кислотой протекает с образованием соответствующего солевого соединения и выделением водорода. Металл отдает электроны кислороду из кислоты, образуя ион металла, который соединяется с кислотными радикалами для образования соли. Водород выделяется в виде газа.
Какие свойства простых веществ металлов позволяют им образовывать сплавы?
Простые вещества металлов обладают высокой металлической проводимостью электричества и тепла, пластичностью и способностью образовывать кристаллическую решетку. Эти свойства позволяют металлам легко взаимодействовать между собой и образовывать сплавы - гомогенные смеси двух или более металлов.
