Ортофосфорная кислота (H3PO4) является одной из наиболее распространенных и важных кислот в химической промышленности. Эта кислота может реагировать с рядом различных металлов, образуя соответствующие фосфаты. Химические реакции металлов с ортофосфорной кислотой представляют особый интерес в связи с их применением во многих областях, включая металлургию, электронику, стекольную промышленность и другие.
При реакции металлов с ортофосфорной кислотой образуются соответствующие фосфаты металлов. Фосфаты металлов обладают различными физическими и химическими свойствами, которые делают их полезными в различных областях применения. Например, фосфаты металлов используются в производстве глинозема, катализаторов, синтетических удобрений и многое другое.
Одной из наиболее известных реакций металлов с ортофосфорной кислотой является реакция железа. При этой реакции образуется фосфат железа (III) (FePO4), который имеет важное применение в производстве керамики, эмалей и красок. Эта реакция особенно интересна с точки зрения термического воздействия на металлы, которое может привести к изменению их свойств и структуры.
Важно отметить, что реакция металлов с ортофосфорной кислотой может проходить при различных условиях, таких как температура, концентрация кислоты и длительность реакции. Это позволяет контролировать процесс образования фосфатов металлов и получать продукты с требуемыми свойствами. Область применения химических реакций металлов с ортофосфорной кислотой огромна и постоянно расширяется благодаря постоянному развитию и исследованиям в области химии и материаловедения.
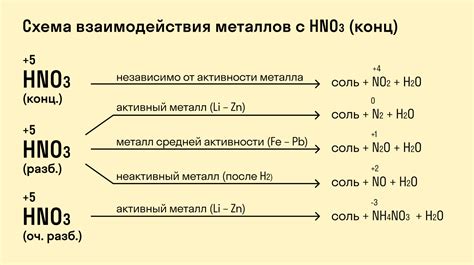
Активность металлов в реакции с ортофосфорной кислотой и ее зависимость от ряда металлов

Активность металлов в химических реакциях с ортофосфорной кислотой зависит от их электрохимических свойств и позиции в ряду активности металлов. Чем выше металл в ряду активности, тем большую активность он проявляет при взаимодействии с кислотой.
Самыми активными металлами являются щелочные и щелочноземельные металлы, такие как литий, натрий, калий, магний и кальций. Они реагируют с ортофосфорной кислотой довольно интенсивно, образуя соответствующие соли и выделяя водород. Эти реакции сопровождаются плавающим разложением кислоты и выделением тепла.
Металлы средней активности, например, цинк, железо и алюминий, также могут реагировать с ортофосфорной кислотой, но их реакция протекает медленнее и менее интенсивно. Они также образуют соли и выделяют водород, но в меньших объемах.
Наконец, наиболее низкой активностью обладают металлы платиновой группы и серебро. Они практически не реагируют с ортофосфорной кислотой и не выделяют водород.
Таким образом, активность металлов в реакции с ортофосфорной кислотой может быть использована для классификации металлов по их реакционной способности. Это знание важно для понимания химических свойств металлов и их применения в различных отраслях промышленности и науки.
Процессы окисления и восстановления металлов при взаимодействии с ортофосфорной кислотой

Ортофосфорная кислота (H3PO4) является сильным окислителем и может взаимодействовать с различными металлами, вызывая процессы окисления и восстановления. В результате этих реакций образуются соответствующие соли фосфорной кислоты.
Металлы, такие как железо (Fe), цинк (Zn), медь (Cu) и алюминий (Al), могут быть окислены при контакте с ортофосфорной кислотой. В процессе окисления металлы отдают электроны, становясь положительно заряженными ионами. При этом ортофосфорная кислота получает электроны и снижается вальентность фосфора.
Процесс окисления металлов сопровождается образованием газов, таких как водород (H2) и фосфин (PH3). Образование газов является характерным признаком окислительно-восстановительных реакций металлов с ортофосфорной кислотой.
В то же время, ортофосфорная кислота может быть восстановлена некоторыми металлами. Восстановление происходит благодаря передаче электронов от металла кислоте, в результате чего образуется гидрофосфат металла и обычная кислота. Восстановительные реакции сопровождаются выделением тепла и света.
Важно отметить, что реакция между металлами и ортофосфорной кислотой зависит от концентрации и температуры кислоты, а также от видов металлов, присутствующих в системе. Некоторые металлы могут быть индифферентными к ортофосфорной кислоте и не проявлять реакций окисления или восстановления.
Примеры и применение реакций металлов с ортофосфорной кислотой в химической и электротехнической промышленности
Реакции металлов с ортофосфорной кислотой имеют широкое применение в химической и электротехнической промышленности. Один из наиболее известных примеров таких реакций - это реакция железа с ортофосфорной кислотой, которая используется для получения феррофосфора.
Феррофосфор - это сплав железа и фосфора, который обладает высокой термической и химической стойкостью. Он широко используется в производстве сталей и сплавов, таких как нержавеющая сталь и сплавы для магнитных материалов. Реакция железа с ортофосфорной кислотой является основной методом получения феррофосфора.
Другим примером реакции металлов с ортофосфорной кислотой является реакция алюминия. При ее проведении происходит выделение газа - фосфористого водорода (PH3), который является очень ядовитым веществом. В промышленности данный газ используется для производства фосфатных удобрений и других химических соединений, а также как промышленный яд или флогистон для сварки и пайки.
Кроме того, реакции металлов с ортофосфорной кислотой находят применение в электротехнической промышленности. Например, реакция алюминия с ортофосфорной кислотой используется для получения осажденного алюминия, который применяется в производстве электродов для аккумуляторов, а также в процессе пайки электрических контактов.
Таким образом, реакции металлов с ортофосфорной кислотой имеют важное применение в химической и электротехнической промышленности, в процессе производства сплавов, сталей, фосфатных удобрений, аккумуляторов и других электрических компонентов.
Уровень безопасности и меры предосторожности при работе с ортофосфорной кислотой и металлами
Ортофосфорная кислота, также известная как фосфорная кислота, является химическим веществом, которое может представлять опасность при неправильном использовании. Поэтому при работе с ней необходимо соблюдать определенные меры безопасности.
- Использование защитного оборудования: При работе с ортофосфорной кислотой следует надеть защитные очки, резиновые перчатки и защитную одежду. Это поможет предотвратить попадание кислоты на кожу, глаза и другие части тела.
- Работа в хорошо проветриваемом помещении: Ортофосфорная кислота испаряется при комнатной температуре и может образовывать пары, которые могут быть вредными для дыхательной системы. Поэтому рекомендуется работать в хорошо проветриваемом помещении или под вытяжкой.
- Правильное хранение и обращение с кислотой: Ортофосфорная кислота должна храниться в герметично закрытой емкости, вдали от источников огня и отдельно от других химических веществ. При работе с кислотой необходимо быть осторожным, чтобы избежать попадания на кожу или одежду. В случае попадания на кожу ортофосфорной кислоты следует немедленно промыть затронутую область водой.
Реакции металлов с ортофосфорной кислотой также могут представлять опасность, поэтому при их проведении необходимо принимать дополнительные меры предосторожности.
- Использование перчаток и защитной одежды: При работе с металлами и ортофосфорной кислотой рекомендуется надевать перчатки и защитную одежду, чтобы предотвратить контакт кислоты с кожей.
- Работа в хорошо проветриваемом помещении: Реакции металлов с ортофосфорной кислотой могут сопровождаться выделением газов. Поэтому для обеспечения безопасности необходимо работать в хорошо проветриваемом помещении.
- Отсутствие контакта с воспламеняющимися веществами: Ортофосфорная кислота может вызывать воспламенение некоторых металлов. Поэтому необходимо избегать контакта кислоты с веществами, которые могут поддерживать горение.
Соблюдение указанных мер безопасности поможет предотвратить возможные риски и обеспечит безопасную работу с ортофосфорной кислотой и металлами.
Вопрос-ответ

Какие металлы могут реагировать с ортофосфорной кислотой?
С ортофосфорной кислотой могут реагировать такие металлы, как натрий, калий, кальций, магний, алюминий и др.
Какую роль играет ортофосфорная кислота в реакциях с металлами?
Ортофосфорная кислота играет роль окислителя в реакциях с металлами. Она отбирает электроны у металла, окисляя его.
Как изменяются свойства металлов после их реакции с ортофосфорной кислотой?
После реакции с ортофосфорной кислотой, свойства металлов могут измениться. Например, металл может раствориться в кислоте, образуя соль, или выделиться газ в результате реакции.
Какой газ выделяется при реакции металлов с ортофосфорной кислотой?
При реакции металлов с ортофосфорной кислотой может выделяться водородный газ (H2). Это происходит, когда металл окисляется водородом из кислоты.
Какие безопасность меры нужно принять при работе с ортофосфорной кислотой и металлами?
При работе с ортофосфорной кислотой и металлами необходимо соблюдать нужные предосторожности, такие как ношение защитной одежды, перчаток и очков, проведение работы в хорошо проветриваемой области, избегание контакта с кислотой на коже и слизистых оболочках, и другие меры безопасности, указанные в инструкции.
