Реакции металлов с концентрированной соляной кислотой – это один из важных процессов, происходящих в химических лабораториях и промышленности. Соляная кислота (HCl) является сильным окислителем и способна реагировать с большинством металлов, образуя соли и выделяя водород. Однако существуют особенности взаимодействия различных металлов с соляной кислотой, которые важно учесть при проведении экспериментов или в промышленных процессах.
При реакции соляной кислоты с активными металлами, такими как натрий (Na) или калий (K), происходит бурное выделение водорода, что сопровождается сильным нагреванием. Данная реакция часто используется в химической промышленности для получения водорода, взрывчатых материалов и других веществ. Кроме того, активные металлы могут образовывать соли соляной кислоты, которые имеют широкое применение в различных отраслях промышленности.
С другой стороны, пассивные металлы, такие как серебро (Ag) или золото (Au), не реагируют с соляной кислотой при комнатной температуре. Однако, при нагревании концентрированной соляной кислотой, эти металлы начинают реагировать, образуя соли и выделяя водород. Это можно использовать для очистки и отполировки поверхности пассивных металлов или для получения их соединений.
Важно отметить, что реакции металлов с концентрированной соляной кислотой часто сопровождаются выделением вредных газов и паров. Поэтому при проведении экспериментов или работы в промышленных условиях необходимо соблюдать меры безопасности и работать в хорошо вентилируемых помещениях или под вытяжкой.
В заключение, реакции металлов с концентрированной соляной кислотой являются важной областью химических и промышленных исследований. Эти реакции имеют свои особенности для разных металлов и могут использоваться для получения солей и водорода, а также для очистки и отполировки поверхностей металлов. Однако, необходимо соблюдать меры безопасности при работе с соляной кислотой и проведении экспериментов.
Реакции цветных металлов с соляной кислотой

Соляная кислота – это одна из наиболее распространённых и сильных минеральных кислот. При контакте с некоторыми металлами она вызывает яркое цветовое изменение, что позволяет использовать данный эффект в химических экспериментах и процессах.
Реакции цветных металлов с соляной кислотой происходят в результате образования хлоридов металлов и выделения газа – хлора. При этом происходит раскрашивание раствора и изменение физических свойств образовавшегося соединения.
К примеру, медь при взаимодействии с соляной кислотой образует зеленоватый раствор медного хлорида и выделяет газ хлор. Железо, в свою очередь, преобразуется в желтоватый раствор железного хлорида с выделением хлора. Никель после взаимодействия с соляной кислотой образует зеленовато-голубой раствор никелевого хлорида и выделяет газ хлор.
Таким образом, реакции цветных металлов с соляной кислотой проявляются в образовании хлоридов и разнообразной окраске растворов. Они широко используются в химических опытах и процессах для получения различных соединений и веществ.
Реакции щелочных металлов с соляной кислотой

Реакции щелочных металлов с соляной кислотой являются одними из наиболее характерных реакций в неорганической химии. Щелочные металлы (например, литий, натрий, калий) химически активны и легко реагируют с кислотами, включая соляную кислоту.
Во время реакции соляная кислота диссоциирует на ионы водорода (H+) и ионы хлорида (Cl-). Щелочные металлы, в свою очередь, обладают активным двух-электронным свободным пространственными электронными оболочками и легко поддаются окислению.
При взаимодействии щелочных металлов с соляной кислотой образуется соль и исключается молекулярный водород. При этом щелочный металл окисляется, а соляная кислота восстанавливается.
Например, в реакции между натрием и соляной кислотой образуется хлорид натрия (NaCl) и выделяется молекулярный водород (H2). Уравнение реакции:
- 2Na + 2HCl → 2NaCl + H2
Реакции щелочных металлов с соляной кислотой широко используются в химической промышленности и аналитической химии. Они являются основой для получения солей щелочных металлов, которые используются в различных отраслях промышленности, в том числе в производстве стекла, мыла и металлов. Также эта реакция часто применяется в химическом анализе для обнаружения и определения щелочных металлов.
Особенности реакций щелочноземельных металлов с соляной кислотой

Щелочноземельные металлы, такие как магний, кальций и алюминий, проявляют особенные химические свойства при взаимодействии с концентрированной соляной кислотой. Эти реакции могут быть полезными как в лабораторной практике, так и в промышленности.
Взаимодействие магния с соляной кислотой позволяет получать магниевый хлорид, который используется в производстве легких сплавов, пищевых добавок и фармацевтических препаратов. При этом реакция сопровождается выделением водорода и образованием характерного газообразного вещества.
Кальций также образует хлорид при взаимодействии с соляной кислотой. Реакция сопровождается выделением водорода и образованием белого осадка. Кальций хлорид используется в производстве бетона, сыпучих материалов и соли для устранения обледенения на дорогах.
Алюминий, в отличие от магния и кальция, не реагирует с соляной кислотой в обычных условиях. Однако, при нагревании алюминия в присутствии соляной кислоты, происходит реакция, в результате которой образуется гидроксид и хлорид алюминия. Эта реакция используется в промышленности для получения алюмокалиевых солей, а также в процессе очистки алюминиевых поверхностей.
Взаимодействие благородных металлов с соляной кислотой

Соляная кислота является сильным окислителем и агрессивной кислотной средой, однако благородные металлы обладают высокой устойчивостью к ее действию. Основные благородные металлы включают платину, золото, серебро и родий.
Взаимодействие благородных металлов с соляной кислотой происходит в зависимости от их электрохимической активности. Они, как правило, не реагируют с соляной кислотой и не окисляются в ее присутствии. Благородные металлы сохраняют свою структуру и химические свойства при контакте с соляной кислотой.
Однако некоторые благородные металлы, такие как платина и золото, могут растворяться в концентрированной соляной кислоте при высоких температурах и длительном воздействии, но такие условия редко встречаются в обычных условиях использования.
Благородные металлы обладают высокой устойчивостью к коррозии и химическому воздействию, что делает их ценными материалами в различных отраслях промышленности. Они широко используются в производстве ювелирных изделий, медицинском оборудовании, электронике и других технических отраслях.
Применение реакций соляной кислоты с металлами в промышленности

1. Получение хлорида металла
Одним из самых распространенных применений реакций соляной кислоты с металлами в промышленности является получение хлорида металла. Множество металлов, таких как железо, медь, никель и др., реагируют с соляной кислотой, образуя соответствующие хлориды металлов. Полученные хлориды металлов широко применяются в различных отраслях промышленности, включая производство химических веществ и материалов.
2. Очистка металлов от посторонних примесей
Реакция металлов с концентрированной соляной кислотой способна удалить различные примеси и загрязнения с поверхности металлов. Это особенно актуально в процессе очистки металлов перед их дальнейшей обработкой или использованием. Например, при производстве электронных компонентов или приготовлении пищевых продуктов требуется использование очищенных и безопасных металлических материалов.
3. Осаждение металлов из растворов
Реакция металлов с соляной кислотой может быть использована для осаждения металлов из растворов. Путем реакции можно получить осажденные соединения металлов, которые затем могут быть использованы в различных технологических процессах или для получения чистых металлических элементов с помощью дальнейших химических преобразований.
4. Регенерация соляной кислоты
После реакции с металлами, соляная кислота может быть использована повторно путем её регенерации. Процесс регенерации соляной кислоты включает разделение и удаление образовавшихся хлоридов металлов, восстановление кислотности и очистку от примесей. Это позволяет эффективно использовать соляную кислоту в рамках производства различных химических веществ и продуктов.
Таким образом, реакции металлов с концентрированной соляной кислотой нашли широкое применение в промышленности, включая получение хлорида металла, очистку металлов от примесей, осаждение металлов из растворов и регенерацию соляной кислоты. Эти процессы играют важную роль в производстве различных химических и материальных продуктов, а также обеспечивают повышенную эффективность использования ресурсов и сокращение отходов.
Особенности реакций алюминия с соляной кислотой

Взаимодействие алюминия с концентрированной соляной кислотой представляет собой химическую реакцию, в результате которой образуется соль алюминия и выделяется водород.
Для начала реакции необходимо активировать поверхность алюминия, что обеспечивается механическим освежением или обработкой поверхности раствором соляной кислоты небольшой концентрации.
Реакция происходит с выделением большого объема водорода, который образуется из молекулы соляной кислоты в результате взаимодействия с алюминием. При этом возникает интенсивное образование пузырьков газа и выделение характерного запаха соляной кислоты.
Реакция протекает в среде соляной кислоты, поэтому необходимо соблюдать меры предосторожности при проведении данного химического эксперимента, так как соляная кислота является агрессивным веществом и может вызывать ожоги и раздражение при попадании на кожу и слизистые оболочки организма.
Получаемая соль алюминия может иметь различную степень гидратации и варьироваться по своей кристаллической структуре. В зависимости от условий проведения реакции, могут образовываться различные виды солей, такие как хлорид алюминия или сульфат алюминия.
Влияние концентрации соляной кислоты на ход реакций с металлами
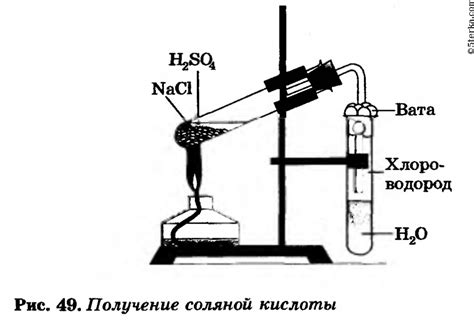
Концентрация соляной кислоты – один из факторов, влияющих на ход реакций металлов с этой кислотой. При взаимодействии металлов с соляной кислотой образуются хлориды металлов и выделяется водород. Реакция протекает на границе фаз и сопровождается выделением тепла. Концентрация соляной кислоты оказывает влияние на скорость реакций и степень их полноты.
При использовании различных концентраций соляной кислоты можно наблюдать разные характеристики реакции металла с кислотой. Если концентрация кислоты низкая, то реакция протекает медленно и может даже остановиться из-за пассивации металла пленкой оксида. С ростом концентрации кислоты скорость реакции увеличивается, так как увеличивается численная концентрация ионов водорода в растворе, что способствует быстрой коррозии металла.
Но также следует отметить, что слишком высокая концентрация соляной кислоты может привести к неэффективности реакции. Когда концентрация кислоты достигает определенного значения, молекулы воды начинают конкурировать с металлом за вступление в реакцию с ионами водорода. В результате, степень полноты реакции снижается, а скорость может стать непредсказуемой.
Использование разных концентраций соляной кислоты позволяет контролировать скорость и полноту реакции металла с кислотой, что находит применение в промышленности для эффективного управления процессами коррозии металлов.
Вопрос-ответ

Какие металлы могут реагировать с концентрированной соляной кислотой?
Различные металлы могут реагировать с концентрированной соляной кислотой, включая цинк, железо, алюминий и многие другие. Однако, реакция может зависеть от конкретных условий и концентрации кислоты.
Какие особенности имеет реакция металлов с концентрированной соляной кислотой?
Реакция металлов с концентрированной соляной кислотой обычно сопровождается выделением газа водорода и растворением металла. В процессе реакции может наблюдаться выделение тепла и образование солей металлов.
