Концентрированная серная кислота (H2SO4) – это один из наиболее распространенных химических реагентов, используемых в лаборатории и промышленности. Ее основное свойство – высокая кислотность, обусловленная наличием двух кислородных атомов и сульфоильной группы в молекуле. Эта кислотность делает серную кислоту сильным окислителем и сильным действующим агентом при реакциях с различными веществами, включая металлы.
Реакция металлов с концентрированной серной кислотой обладает высокой степенью экзотермичности и может протекать с образованием большого количества тепла и выделением газов. В ходе реакции металлы вступают в контакт со свободными протонами из серной кислоты, что приводит к образованию соответствующих солей и выделению водорода.
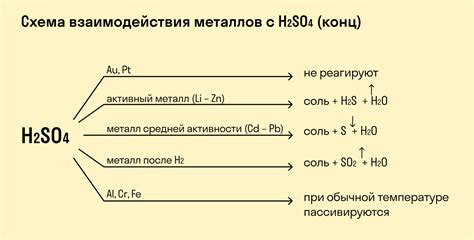
Важно отметить, что не все металлы одинаково реагируют с концентрированной серной кислотой. Некоторые металлы, такие как золото и платина, являются химически инертными и практически не реагируют с серной кислотой.
Для более активных металлов реакция с серной кислотой проходит более интенсивно. В результате реакции образуются соответствующие соли – сульфаты металлов. Однако, некоторые металлы могут вызывать более сложные реакции, такие как образование пероксидов и сульфоксидов. Кроме того, при взаимодействии некоторых металлов с серной кислотой могут возникать искры и пламя, что связано с высокой степенью реакционной активности веществ.
Химические реакции металлов с концентрированной серной кислотой

Концентрированная серная кислота – это один из самых сильных химических реагентов, которым можно проводить эксперименты на органических и неорганических веществах. Одним из интересных объектов для реакции с этой кислотой являются металлы. Под воздействием концентрированной серной кислоты металлы проявляют различные химические свойства, такие как окисление, выделение газов и образование солей.
Реакция металла с концентрированной серной кислотой может протекать с выделением водорода, который может быть обнаружен появлением пузырьков газа. Это типичная реакция цинка, железа, меди, никеля и многих других металлов. Водород, образующийся при таких реакциях, обладает высокой реакционной способностью и может быть использован в химических процессах.
Однако не все металлы реагируют со срастворенной серной кислотой. Например, золото, платина и серебро пассивны и практически не реагируют с этой кислотой. Часть металлов реагирует лишь с разогретой концентрированной серной кислотой.
Реакция металлов с концентрированной серной кислотой часто сопровождается образованием солей. Например, при растворении цинка в серной кислоте образуется сульфат цинка, который является солью. Образование солей в ходе реакций позволяет получать различные продукты и использовать металлы в промышленности и научных исследованиях.
Химические свойства металлов:

Металлы обладают рядом характерных химических свойств, которые определяют их активность и способность взаимодействовать с другими веществами.
Активность металлов: Химическая активность металлов зависит от их положения в ряду активности металлов. Наиболее активные металлы располагаются в верхней части ряда, например, щелочные металлы (натрий, калий, литий) и щелочноземельные металлы (магний, кальций, барий). Эти металлы быстро реагируют с кислородом, водой и кислотами.
Образование ионы металлов: При химических реакциях металлы обычно образуют положительно заряженные ионы (катионы). Количество электронов, которые отдают металлы, зависит от их электроотрицательности. Наиболее активные металлы, такие как натрий и калий, отдают один электрон, образуя одновалентные ионы. В то время как менее активные металлы, например, железо и медь, могут образовывать двухвалентные ионы.
Взаимодействие металлов с кислотами: Многие металлы проявляют свою активность при взаимодействии с кислотами. Кислоты могут растворять металлы, образуя соли и выделяя водород. Например, при взаимодействии железа с концентрированной серной кислотой образуется сульфат железа и выделяется водородный газ.
Реакция металлов с кислородом: Многие металлы проявляют свою реактивность при контакте с кислородом, образуя окислы. Эта реакция называется окислением металлов. Например, при нагревании меди в присутствии кислорода образуется черный оксид меди.
Реакция металлов с водой: Некоторые металлы могут реагировать с водой, образуя металлические оксиды и выделяя водородный газ. Наиболее реактивные металлы, такие как натрий и калий, образуют щелочи и выделяются большое количество горючего водорода.
Реакция щелочных металлов с серной кислотой:
Щелочные металлы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), обладают химической активностью и проявляют реактивность при контакте с серной кислотой. Различные металлы будут вести себя по-разному, но общей чертой реакции является образование водорода.
При реакции щелочных металлов с серной кислотой происходит образование солей металлов и освобождение водорода. Данная реакция можно представить следующим уравнением:
2M + H2SO4 → MSO4 + 2H2
Где M - щелочный металл.
Реакция между металлом и серной кислотой протекает очень быстро, с выделением газообразного водорода. Важно помнить, что эта реакция является экзотермической, то есть сопровождается выделением тепла.
Соли, образующиеся в результате реакции щелочных металлов с серной кислотой, обладают существенными свойствами и широко используются в промышленности и химической лаборатории. Эти соли могут применяться в качестве стабилизаторов, катализаторов или компонентов в производстве различных продуктов.
- Литийсульфат (Li2SO4) - используется в электролитах для литий-ионных аккумуляторов.
- Натрийсульфат (Na2SO4) - широко применяется в стекольной промышленности, производстве моющих средств, а также в лабораторной практике.
- Калийсульфат (K2SO4) - используется в качестве удобрения и питательных средств для растений.
Эти примеры подтверждают, что реакция щелочных металлов с серной кислотой имеет практическое значение и находит применение в различных областях нашей жизни.
Реакция щелочноземельных металлов с серной кислотой:

Щелочноземельные металлы - это элементы второй группы периодической таблицы, включающие бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они образуют щелочные оксиды и гидроксиды, которые реагируют с кислотами, в том числе и с серной кислотой.
При взаимодействии щелочноземельных металлов с серной кислотой происходит образование соответствующих солей и выделение водорода. Реакция идет с выделением тепла и сопровождается возможным образованием сернистого газа.
Например, магний (Mg) реагирует с серной кислотой (H2SO4) по следующему уравнению:
Mg + H2SO4 → MgSO4 + H2
При реакции образуется соль серы (MgSO4), которая остается растворенной в реакционной среде, и образуется молекулярный водород (H2), который можно обнаружить по характерным свойствам.
Реакция щелочноземельных металлов с серной кислотой протекает спонтанно и может быть использована в лаборатории для получения солей щелочноземельных металлов.
Реакция переходных металлов с серной кислотой:

Серная кислота является одним из наиболее распространенных и активных окислителей. Она способна реагировать с различными металлами, в том числе и с переходными металлами. Реакция переходных металлов с серной кислотой обладает своими особенностями и может привести к образованию различных продуктов.
Переходные металлы, такие как железо, медь, никель, хром и другие, могут реагировать с концентрированной серной кислотой образуя соли серной кислоты. Например, при реакции железа с серной кислотой образуется соль железа(II)серной кислоты – сернокислое железо(II) или сульфат железа(II), которая имеет химическую формулу FeSO₄.
Реакция переходных металлов с серной кислотой может сопровождаться выделением газов. Например, при реакции цинка с серной кислотой образуется соль цинка(II)серной кислоты – сернокислое цинк(II) или сульфат цинка(II), а также выделяется водородный газ. Этот газ можно обнаружить, проводя горячую медную проволоку над реакционной смесью – он будет загораться.
При реакции меди с концентрированной серной кислотой образуется соль меди(II)серной кислоты – сернокислая медь(II) или сульфат меди(II). Реакция сопровождается выделением газа диоксида серы, обнаружить который можно, проводя над реакционной смесью серную бумагу – она загорится.
Таким образом, реакции переходных металлов с серной кислотой представляют собой химические превращения, которые приводят к образованию солей серной кислоты и выделению газов. Эти реакции находят широкое применение как в лабораторной практике, так и в промышленности, например, при производстве сульфата железа и сульфата цинка.
Реакция благородных металлов с серной кислотой:

Реакция благородных металлов с серной кислотой является весьма специфичной и обладает рядом характерных особенностей.
В отличие от большинства других металлов, благородные металлы, такие как золото, платина и серебро, обладают высокой стойкостью к агрессивным кислотам, включая серную кислоту.
Серная кислота, действуя на благородные металлы, образует с ними стойкие соединения, которые позволяют данным металлам сохранять свои физические и химические свойства.
Реакция между серной кислотой и благородными металлами протекает очень медленно, и с образованием ограниченного количества продуктов.
Также благородные металлы служат эффективными катализаторами для многих реакций, включая окисление органических соединений серной кислотой.
Благородные металлы имеют высокую коррозионную стойкость в серной кислоте, что позволяет использовать их в различных промышленных процессах, где требуется контакт с этой кислотой.
Металлы и их способность реагировать с концентрированной серной кислотой:

Металлы обладают различными свойствами и могут проявлять разную способность к реакции с концентрированной серной кислотой. Реакция металлов с серной кислотой может протекать с выделением газов, образованием соответствующих солей и изменением цвета реагентов.
Некоторые металлы, такие как железо, цинк и алюминий, обладают высокой активностью и способны реагировать с концентрированной серной кислотой. В результате такой реакции могут образовываться соответствующие соли и выделяться газы, например, сероводород.
Другие металлы, такие как медь и серебро, обладают низкой активностью и не проявляют скорой реакции с концентрированной серной кислотой. Однако, если такая реакция все-таки происходит, то она может сопровождаться изменением цвета реагентов и образованием соответствующих солей.
Интересно отметить, что реакция металлов с концентрированной серной кислотой может быть использована для определения активности металлов и их коррозионной стойкости. Кроме того, данная реакция является важным шагом в процессе получения различных металлических соединений и солей. Важно помнить, что реакция металлов с концентрированной серной кислотой является опасной и требует соблюдения соответствующих мер предосторожности.
Вопрос-ответ

Как происходит реакция алюминия с концентрированной серной кислотой?
Когда алюминий вступает в контакт с концентрированной серной кислотой, происходит эндотермическая (поглощающая тепло) реакция. На первом этапе образуется сернистый алюминий (Al2(SO4)3), а на втором этапе в раствор выделяются газы сернистый ангидрид (SO2) и диоксид серы (SO3).
Как происходит реакция цинка с концентрированной серной кислотой?
При взаимодействии цинка с концентрированной серной кислотой образуется сульфат цинка (ZnSO4) и выделяется водородный газ (H2). Эта реакция происходит достаточно активно и сопровождается выделением тепла.
Что происходит при реакции железа с концентрированной серной кислотой?
При контакте железа с концентрированной серной кислотой возникает реакция, в результате которой образуется сульфат железа (Fe2(SO4)3) и выделяется водородный газ (H2). Реакция протекает активно с выделением тепла.
