Реакции металлов с кислотами являются одним из фундаментальных процессов в химии. Они позволяют изучать свойства металлов, их химическую активность, а также определять и классифицировать их. Кроме того, эти реакции важны в промышленности, так как многие металлы используются в различных процессах производства.
Основной характеристикой реакций металлов с кислотами является образование солей и выделение водорода. При этом различные металлы проявляют разную активность в реакциях с кислотами. Например, щелочные металлы, такие как натрий или калий, реагируют с кислотами очень активно, в то время как металлы благородных металлов, такие как золото или платина, не реагируют с кислотами вообще.
В зависимости от конкретных условий, реакции металлов с кислотами могут протекать с разной интенсивностью. Например, если кислота очень концентрированная, то реакция может идти быстро и с высокой энергией выделения газа. Если же кислота разбавлена, то реакция может идти более медленно, а интенсивность выделения газа будет ниже.
Особенности химических реакций металлов с кислотами

Химические реакции металлов с кислотами – это важные процессы, которые происходят в химии. Эти реакции имеют свои особенности и свойства, которые определяются химическим составом и структурой веществ.
Кислоты могут быть различными: соляная, серная, уксусная и другие. Реагентом в таких реакциях выступает металл, который вступает в химическую связь с кислотой. В результате этой реакции образуется соль и выделяется водород.
Свойства металлов определяют различные реакции металлов с кислотами. Некоторые металлы очень активны и реагируют с кислотами быстро и энергично, например, натрий или калий. Другие металлы, такие как железо или цинк, реагируют медленнее и с выделением водорода.
Один из параметров химической реакции металла с кислотой – это активность металла. Она зависит от электронной структуры металла, его реакционной способности и температуры. Чем активнее металл, тем легче он взаимодействует с кислотой.
Реакции металлов с кислотами могут протекать по разным механизмам: замещение водорода, растворение металла в кислоте или образование комплексных соединений. Все эти процессы имеют свои особенности и протекают с разными скоростями.
Металлы и их свойства в химических реакциях

Металлы представляют собой важную группу химических элементов, обладающих рядом уникальных свойств, которые активно проявляются в химических реакциях. Одним из таких свойств является электропроводность, которая делает металлы отличными проводниками электричества.
Металлы часто вступают в реакцию с кислотами, образуя соли и выделяя газы. Это явление объясняется тем, что металлы активно отдают свои электроны, что приводит к окислению металла и образованию ионов металла положительной зарядности.
Как правило, при взаимодействии металлов с кислотами образуются соли металлов и выделяется водород. Этот процесс называется реакцией замещения, когда более активный металл замещает менее активный металл в соли.
В химических реакциях с участием металлов и кислот важную роль играет также растворимость солей металлов. Некоторые металлы, например, натрий и калий, образуют хорошо растворимые соли, тогда как другие металлы, например, железо и свинец, образуют мало растворимые соли.
Таким образом, металлы и их свойства играют важную роль в химических реакциях, особенно при взаимодействии с кислотами. Они активны, электропроводны и способны образовывать различные соли и выделять газы, что делает их незаменимыми во многих промышленных и научных процессах.
Взаимодействие кислот с металлами: механизм и реакционные продукты
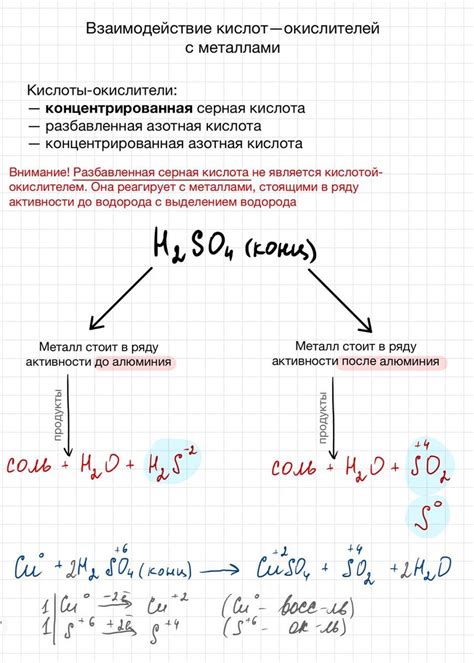
Взаимодействие кислот с металлами представляет собой процесс, при котором происходит химическая реакция между металлом и кислотой. Как правило, в результате таких реакций образуются соли и выделяется водород.
Механизм взаимодействия металла с кислотой зависит от их химических свойств. Некоторые металлы, например, активные щелочные металлы, могут реагировать с водой вместо кислоты. Обычно, кислоты вступают в реакцию с металлами, освобождая водородный газ. Эта реакция происходит через образование промежуточного комплекса металла и кислоты, что и приводит к выделению водорода и образованию соли.
Реакционные продукты взаимодействия кислот с металлами являются солями и водородом. Например, взаимодействие соляной кислоты с цинком приводит к образованию хлорида цинка и выделению водорода: Zn + 2HCl = ZnCl2 + H2. Также, при взаимодействии серной кислоты с железом образуется сульфат железа и выделяется водород: Fe + H2SO4 = FeSO4 + H2.
Таблица ниже приводит примеры реакций кислот с различными металлами:
| Кислота | Металл | Реакционный продукт |
| Соляная кислота (HCl) | Цинк (Zn) | Хлорид цинка (ZnCl2) и водород (H2) |
| Серная кислота (H2SO4) | Железо (Fe) | Сульфат железа (FeSO4) и водород (H2) |
| Уксусная кислота (CH3COOH) | Алюминий (Al) | Ацетат алюминия (Al(CH3COO)3) и водород (H2) |
Особенности и свойства реакций металлов с кислотами зависят от различных факторов, таких как концентрация и температура кислоты, химические свойства металла и т. д. Изучение этих реакций является важным аспектом химического образования и может иметь практическое применение в различных областях, таких как производство солей и выделение водорода.
Значение химических реакций металлов с кислотами в жизни человека

Химические реакции металлов с кислотами имеют важное значение в жизни человека и применяются в различных областях. Одним из наиболее значимых применений этих реакций является получение водорода. Водород является одним из основных энергоносителей и используется в производстве различных горюче-смазочных материалов.
Также химические реакции металлов с кислотами широко применяются в процессе очистки отработанных масел и топлива. При реакции металлического натрия с серной кислотой, например, образуется натриевая соль и водород. Водород, в свою очередь, применяется в процессе реформинга топлива, что позволяет увеличить его октановое число и снизить эмиссию вредных веществ.
Технология химической очистки отработанных масел и топлива значительно снижает негативное воздействие этих отходов на окружающую среду. Процесс происходит при низкой температуре и позволяет избежать применения высокотемпературных и высоконапорных установок.
Следует отметить, что химические реакции металлов с кислотами также находят применение в процессе очистки отложений на металлических поверхностях. Реакция железа с соляной кислотой, например, образует растворимые соли, которые легко удаляются из поверхности при помощи воды или других растворов. Это позволяет поддерживать металлические конструкции в хорошем состоянии и продлевает их срок службы.
Вопрос-ответ

Какие металлы реагируют с кислотами?
Металлы, которые реагируют с кислотами, включают в себя такие элементы, как цинк (Zn), железо (Fe), магний (Mg), алюминий (Al) и многие другие.
Что происходит при реакции металлов с кислотами?
Во время реакции металла с кислотой происходит образование соли и выделение водорода. Металл активно вступает во взаимодействие с кислородом из кислоты, образуя оксид металла и выделяя молекулы водорода.
Каковы особенности реакций металлов с кислотами?
Особенностью реакций металлов с кислотами является то, что скорость и интенсивность реакции зависят от свойств металла и кислоты, их концентрации и температуры. Эти реакции сопровождаются выделением газа, изменением цвета и запаха, а также образованием осадка.
