Металлы являются одной из основных групп химических элементов, обладающих высокой электропроводностью и способностью образовывать сплавы. Взаимодействие металлов с кислородом является одним из ключевых процессов, которые происходят в природе и в промышленности.
Основная реакция, которая происходит при взаимодействии металлов с кислородом, - это окисление металла. Кислород из воздуха вступает в реакцию с поверхностью металла, образуя оксид металла. Этот процесс является необратимым и приводит к образованию соединений, которые имеют различные физические и химические свойства.
Одним из самых известных примеров реакции металла с кислородом является ржавление железа. Поверхностный слой железа реагирует с кислородом из воздуха, образуя гематит (оксид железа). Это приводит к образованию корки ржавчины, которая может привести к разрушению металла.
Важно отметить, что способность металлов вступать в реакцию с кислородом зависит от ряда факторов, таких как температура, окружающая среда и наличие примесей.
Окислительные свойства металлов сыграли значительную роль в развитии промышленности и технологий. Некоторые металлы, такие как алюминий и магний, обладают высокой антикоррозионной стойкостью и используются в производстве авиационной и автомобильной промышленности.
Таким образом, процессы взаимодействия металлов с кислородом и образование соединений имеют большое значение в химии и промышленности. Изучение этих реакций помогает нам лучше понять свойства и поведение металлов, а также разрабатывать новые материалы с необходимыми химическими и физическими свойствами.
Реакции металлов с кислородом

Металлы активно взаимодействуют с кислородом, что может приводить к образованию различных соединений. Реакция металлов с кислородом может протекать при нагревании, взаимодействии с кислородом воздуха или воды.
При нагревании металлы могут реагировать с кислородом из воздуха, образуя оксиды. Например, нагревание меди с кислородом приводит к образованию черной пыли оксида меди (II), CuO. Алюминий при нагревании с кислородом формирует белый порошок оксида алюминия, Al2O3. Эти оксиды металлов имеют различные физические и химические свойства и широко используются в промышленности.
Взаимодействие металлов с кислородом в воздухе также может вызывать окисление металла и образование пленки оксида. Например, когда железо окисляется в воздухе, на его поверхности образуется слой ржавчины, который представляет собой смесь различных оксидов железа.
Еще одним примером реакции металлов с кислородом является взаимодействие металлов с кислородом воды. Например, при реакции натрия с водой образуется натриевый гидроксид и выделяется водород. Эта реакция каталитически активна, поэтому натрий быстро реагирует с водой и может даже вызвать взрыв.
Таким образом, реакции металлов с кислородом представляют важную часть химических процессов в природе и промышленности. Они являются основой для получения различных соединений, а также могут иметь существенное значение для функционирования живых организмов.
Взаимодействие кислорода с металлами
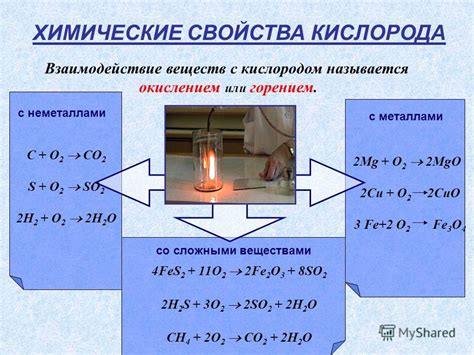
Взаимодействие кислорода с металлами - это процесс, в результате которого образуются оксиды металлов. Кислород является активным элементом, обладающим высокой аффинностью к электронам, поэтому он способен вступать в химическую связь с металлами.
При взаимодействии кислорода с металлами происходит окисление металла. Это означает, что металл отдает электроны кислороду, образуя положительно заряженные ионы металла. Кислород, в свою очередь, принимает эти электроны и образует отрицательно заряженные ионы, заключенные в оксид металла.
В результате взаимодействия кислорода с металлами образуются различные оксиды металлов. Оксиды могут иметь разную степень окисления металла, что определяет их свойства и применение. Некоторые оксиды металлов являются химически инертными и обладают высокой степенью стабильности, например, оксид алюминия. Другие оксиды могут обладать кислотными свойствами и реагировать с водой или кислотами, например, оксид железа.
Взаимодействие кислорода с металлами может происходить при нагревании, при наличии катализаторов или просто в присутствии влаги и кислорода воздуха. Это важный процесс, который определяет формирование оксидной пленки на поверхности металла, что может влиять на его коррозионную стойкость и другие физические и химические свойства.
Понятие окисления и восстановления

Окисление и восстановление - это ключевые процессы, происходящие при взаимодействии металлов с кислородом и образовании соединений. Окисление - это процесс, при котором металл отдает электроны, становясь положительно заряженным и образуя положительный ион. Восстановление же - это обратный процесс, при котором металл получает электроны, изменяя свою зарядность и образуя отрицательный ион.
Под воздействием кислорода происходит окисление металла, в результате которого образуются оксиды. Оксиды металлов главным образом обладают ковалентными характеристиками, но частично могут образовывать и ионные соединения. В процессе окисления металл отдает электроны, переходя в новое состояние окисления.
Восстановление, напротив, происходит при взаимодействии с веществами, способными отдавать электроны. При этом металл принимает электроны и уменьшает свою зарядность. В результате образуются восстановленные соединения металлов. Процесс восстановления играет важную роль в металлургии, где осуществляется восстановление окисленного металла для получения промышленных соединений и продуктов.
Окисление и восстановление являются обратными реакциями, тесно связанными между собой. Они играют важную роль в химических процессах, определяя свойства металлов и их способность взаимодействовать с кислородом и другими веществами. Понимание этих процессов позволяет контролировать химические реакции и использовать металлы в различных отраслях промышленности.
Особенности реакций разных металлов с кислородом

1. Щелочные металлы: Щелочные металлы, такие как литий, натрий и калий, реагируют с кислородом стремительно и ярко. При этом образуется оксид металла, обладающий высокой химической активностью.
2. Щелочноземельные металлы: Щелочноземельные металлы, такие как магний, кальций и барий, реагируют с кислородом менее активно, но все равно образуется оксид металла. При этом образуется более стабильный оксид, который обуславливает полезные свойства этих металлов, например, способность к тушению пламени.
3. Переходные металлы: Переходные металлы, такие как железо, медь и цинк, могут реагировать с кислородом в разных степенях окисления, образуя оксиды с различными свойствами. Эти оксиды часто используются в производстве красителей, керамики и других материалов.
4. Появление пленки оксида: При взаимодействии металлов с кислородом образуется тонкая пленка оксида на поверхности металла, которая защищает металл от дальнейшего окисления. Это явление называется пассивацией и является одной из основных особенностей реакции металлов с кислородом.
5. Влияние температуры: Реакция металлов с кислородом может зависеть от температуры. Например, некоторые металлы, такие как алюминий и титан, могут образовывать защитную пленку оксида только при определенной температуре, что позволяет им быть устойчивыми к окислению при высоких температурах.
6. Интеракция с водой: Некоторые металлы, такие как натрий и калий, реагируют с кислородом не только в атмосфере, но и в воде. При этом образуются гидроксиды металлов, что может приводить к образованию щелочей и повышенной щелочности растворов.
Образование оксидов и гидроксидов

Процессы взаимодействия металлов с кислородом ведут к образованию различных соединений, в основном оксидов и гидроксидов. Оксиды представляют собой соединения металла с кислородом, в которых кислород имеет заряд -2. Гидроксиды, в свою очередь, представляют собой соединения металла с гидроксильной группой (OH-).
Образование оксидов происходит в результате окисления металла кислородом из воздуха или воды. Оксиды обладают химической активностью и способностью взаимодействовать с различными веществами. Некоторые оксиды обладают кислотными свойствами и способны реагировать с основаниями, образуя соли и воду.
Гидроксиды формируются при реакции металла с водой или щелочью. Гидроксиды обладают щелочными свойствами и реагируют с кислотами, образуя соли и воду. Некоторые гидроксиды обладают амфотерными свойствами и способны реагировать как с кислотами, так и с основаниями.
Формулы оксидов и гидроксидов зависят от типа металла и степени окисления металла в соединении. Например, для образования оксида железа(III) (Fe2O3) металл железа окисляется до степени окисления +3, а для образования гидроксида железа(III) (Fe(OH)3) металл железа окисляется до степени окисления +3, а затем образуется соединение с гидроксильной группой.
Образование оксидов и гидроксидов имеет широкое практическое применение. Например, оксиды используются как катализаторы в различных химических реакциях и в производстве красок, а гидроксиды применяются в процессе нейтрализации воды и обработки сточных вод, а также в производстве мыла и моющих средств.
Физические свойства оксидов металлов

Оксиды металлов представляют собой химические соединения, образующиеся при взаимодействии металлов с кислородом. Эти соединения обладают различными физическими свойствами, которые зависят от химической структуры и состава оксида.
Оксиды металлов часто обладают высокой плотностью и твердостью. Некоторые из них имеют кристаллическую структуру, что придает им определенную регулярность и упорядоченность. В результате этого оксиды металлов обычно являются хрупкими и легко разрушаются при механическом воздействии.
Оксиды металлов обычно обладают высокой температурой плавления и кипения. Некоторые из них могут быть твердыми веществами при комнатной температуре, а другие - жидкими или газообразными. Также оксиды металлов могут обладать яркими окрасками, что делает их применимыми в качестве пигментов для красок и керамики.
Оксиды металлов обладают высокой проводимостью тепла и электричества. Это свойство обусловлено наличием свободных электронов в структуре оксида, которые легко перемещаются и способствуют передаче тепла и электрического тока. Именно благодаря этим свойствам некоторые оксиды металлов (например, оксиды меди и алюминия) широко используются в электронике и электротехнике.
Некоторые оксиды металлов обладают магнитными свойствами. Это связано с наличием в структуре оксида атомов металла со спиновым магнитным моментом, которые ориентируются во внешнем магнитном поле и придают оксиду магнитные свойства. Это делает данные оксиды применимыми в производстве магнитов и магнитных материалов.
Химические свойства оксидов металлов
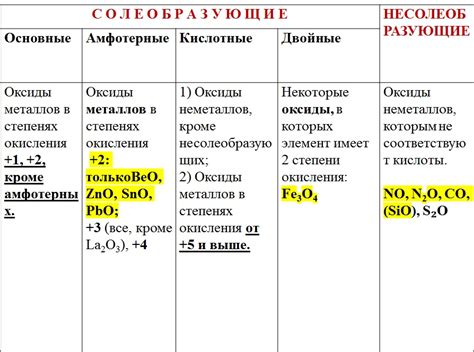
Оксиды металлов представляют собой химические соединения, состоящие из металла и кислорода. Они обладают разнообразными химическими свойствами, которые определяют их роль в различных химических процессах.
Оксиды металлов могут проявлять кислотные, щелочные или амфотерные свойства. В зависимости от этого они могут образовывать кислотные или щелочные растворы при контакте с водой.
Некоторые оксиды металлов обладают высокой реакционной способностью и могут реагировать с веществами, например, с кислотами или основаниями. Такие реакции могут протекать с образованием солей или других соединений.
Оксиды металлов также могут проявлять каталитическую активность, то есть способность ускорять химические реакции без участия в них. Благодаря этому свойству они находят широкое применение в производстве различных химических веществ и материалов.
Оксиды металлов могут образовывать различные структуры, например, монокристаллы, поликристаллические структуры или аморфные материалы. Это свойство влияет на их физические и химические свойства, такие как твердость, плотность, электропроводность и т.д.
Знание химических свойств оксидов металлов позволяет эффективно использовать их в различных сферах деятельности, начиная от промышленности и заканчивая научными исследованиями. Стабильность, реакционная способность и другие химические свойства оксидов металлов делают их важными компонентами многих химических систем.
Применение оксидов металлов в промышленности

Оксиды металлов играют важную роль в различных отраслях промышленности благодаря своим уникальным свойствам и способностям. Они широко используются в процессах производства и имеют множество применений.
Один из наиболее распространенных оксидов металлов - оксид железа (III). Этот оксид широко используется в производстве стали и других металлических сплавов. Он играет роль катализатора в реакциях окисления-восстановления и служит основным источником железа для металлургического производства.
Оксид алюминия – еще один важный оксид металла, применяемый в промышленности. Он используется в производстве керамики, стекла, абразивных материалов и защитных покрытий. Оксид алюминия обладает высокой термической стойкостью и химической инертностью, что делает его отличным материалом для различных промышленных процессов.
Оксид цинка широко используется в производстве резиновых изделий, лакокрасочных материалов, пигментов и электроники. Он обладает светоотражающими свойствами, устойчивостью к коррозии и прозрачностью для видимого света, что делает его полезным материалом в различных промышленных процессах.
Оксид титана является важным компонентом в производстве красок, пигментов, пластиков и солнечных батарей. Он обладает высокой степенью белизны, устойчивостью к УФ-излучению и химической инертностью. Оксид титана находит применение также в косметической и фармацевтической промышленности.
Также стоит отметить оксид магния, который используется в производстве огнеупорных материалов, керамики, стекла, магниевых сплавов и многого другого. Оксид магния обладает высокими термическими свойствами и устойчивостью к химическим реакциям, что делает его важным материалом в многих отраслях промышленности.
Таким образом, применение оксидов металлов в промышленности позволяет создавать широкий спектр продуктов и материалов, которые находят применение в различных областях, от металлургии до фармацевтики. Их свойства и функциональность делают их важными компонентами производственных процессов, способствуя прогрессу и инновациям в промышленности.
Влияние окислительно-восстановительных реакций на окружающую среду

Окислительно-восстановительные реакции, происходящие при взаимодействии металлов с кислородом, оказывают значительное влияние на окружающую среду. Эти процессы являются неотъемлемой частью химических превращений, происходящих в атмосфере, водных ресурсах и почве.
Одним из основных последствий окислительно-восстановительных реакций является образование окисей металлов. Эти окиси, попадая в атмосферу, могут вызывать загрязнение воздуха и ухудшение качества атмосферных осадков. Кроме того, окиси металлов во взаимодействии с влагой могут образовывать кислотные соединения, которые приводят к кислотным дождям и негативно влияют на растительный и животный мир.
Окислительно-восстановительные реакции также оказывают влияние на водные ресурсы. Металлы, попадая в воду в результате окислительных реакций, могут накапливаться в организмах живых организмов, что может привести к отравлению и нарушению биологического равновесия в водных экосистемах. Более того, некоторые металлы, такие как ртуть и свинец, являются тяжелыми металлами и могут накапливаться в организмах людей, что представляет угрозу для здоровья человека.
Для минимизации влияния окислительно-восстановительных реакций на окружающую среду необходимо применять методы очистки воздуха и воды от вредных окисей металлов. Также следует ограничивать выбросы металлов в окружающую среду и принимать меры по повышению эффективности и экологической безопасности процессов взаимодействия металлов с кислородом.
Вопрос-ответ

Какие металлы реагируют с кислородом и образуют соединения?
Реакция металлов с кислородом возможна у большинства химических элементов, но наиболее активно реагируют такие металлы, как литий, натрий, калий, магний, алюминий, железо, медь.
Как происходит процесс взаимодействия металлов с кислородом?
Взаимодействие металлов с кислородом происходит путем окисления металла. Металл отдает свои электроны, а кислород принимает их, образуя отрицательные ионы оксида. К примеру, взаимодействие железа с кислородом приводит к образованию оксида железа.
Какие соединения образуются при взаимодействии металлов с кислородом?
При взаимодействии металлов с кислородом образуются оксиды. Например, при взаимодействии алюминия и кислорода образуется оксид алюминия (Al2O3), при взаимодействии железа и кислорода образуется оксид железа (Fe2O3).
Какие факторы влияют на скорость реакции металла с кислородом?
На скорость реакции металла с кислородом влияют различные факторы, включая температуру, поверхность металла, концентрацию кислорода, наличие катализаторов. Высокая температура и большая поверхность металла способствуют ускорению реакции.
Зачем нужно изучать процессы взаимодействия металлов с кислородом?
Изучение процессов взаимодействия металлов с кислородом важно для понимания различных химических реакций и применения этого знания в сферах, таких как металлургия, производство материалов, энергетика и т.д. Также изучение этих процессов помогает развивать новые методы защиты металлов от окисления и коррозии.
