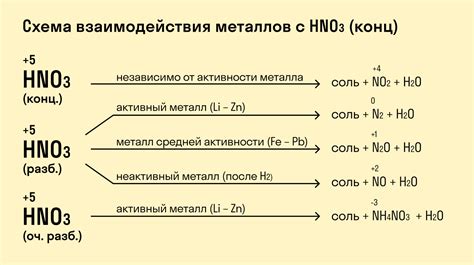
Взаимодействие металла с концентрированными кислотами представляет собой важное явление в химии и материаловедении. Кислоты могут вызывать различные реакции с металлическими материалами, в результате чего может происходить их разрушение или модификация. Понимание основных принципов взаимодействия металла с кислотами позволяет контролировать эти процессы и применять металлы в соответствии с требованиями конкретной задачи.
При взаимодействии с концентрированными кислотами, такими как серная, соляная или азотная кислота, металл может подвергаться реакциям окисления. В результате этих реакций образуются соли с кислотой и выделяется водород, что может привести к коррозии, образованию дырок или повреждению металлического материала. В то же время, некоторые металлы, такие как нержавеющая сталь или платина, обладают высокой устойчивостью к кислотам и не подвергаются разрушению.
Примером взаимодействия металла с концентрированной кислотой может служить действие азотной кислоты на медную проволоку. При реакции образуется азотистый оксид, который выделяется в виде голубых газов. Эта реакция может быть использована для демонстрации свойств азотной кислоты и нарушения целостности медной проволоки.
Химический процесс при контакте металла с концентрированной кислотой
Когда металл контактирует с концентрированной кислотой, происходит химическая реакция, результатом которой является образование соли и выделение водорода. Этот процесс называется коррозией металла и является причиной разрушения металлических конструкций и изделий.
Коррозия металла при взаимодействии с концентрированной кислотой происходит из-за электрохимического процесса, который называется окислительно-восстановительной реакцией. В результате этой реакции, проходящей на поверхности металла, происходит перенос электронов, что приводит к разрушению металлической структуры.
Вода, содержащаяся в концентрированной кислоте, участвует в процессе коррозии, так как способствует проведению электрического тока между металлом и кислотой. Это позволяет активировать окислительно-восстановительные реакции и ускоряет коррозию металла.
Примером химического процесса при взаимодействии металла с концентрированной кислотой можно привести реакцию активного металла натрия с концентрированной серной кислотой. При этом образуется соль натрия и выделяется водород. Уравнение реакции выглядит следующим образом:
2Na + H2SO4 → Na2SO4 + H2
Как видно из этого примера, в результате реакции формируется соль натрия (Na2SO4) и выделяется молекулярный водород (H2), который образует газообразные пузырьки.
Роль металлов при взаимодействии с концентрированными кислотами

Взаимодействие металлов с концентрированными кислотами имеет большое значение в различных областях, таких как химическая промышленность и лабораторная практика. Металлы играют важную роль в реакциях с кислотами, проявляя как положительные, так и отрицательные свойства, в зависимости от условий и типа кислоты.
Один из главных эффектов, происходящих при взаимодействии металлов с концентрированными кислотами, - это их растворение. Металлы могут растворяться в кислотных реагентах, превращаясь в соответствующие ионы. Например, сталь может растворяться в серной кислоте, образуя сульфат железа.
Некоторые металлы, такие как алюминий и цинк, обладают способностью реагировать с кислотами и выделяться в виде газовых продуктов. Например, при взаимодействии цинка с соляной кислотой выделяется водородный газ.
Металлы также могут служить катализаторами реакций с кислотами, ускоряя их протекание. Катализаторы металлов способны активировать молекулы кислот, облегчая их разрушение и ускоряя реакции с другими веществами.
Однако, взаимодействие металлов с концентрированными кислотами может быть и разрушительным. Некоторые металлы, такие как магний и алюминий, не выдерживают длительного воздействия кислот и могут разрушаться или терять свои свойства. Поэтому важно учитывать химическую совместимость металлов с кислотами при выборе материалов для конкретных целей.
Примеры химических реакций между металлами и концентрированными кислотами
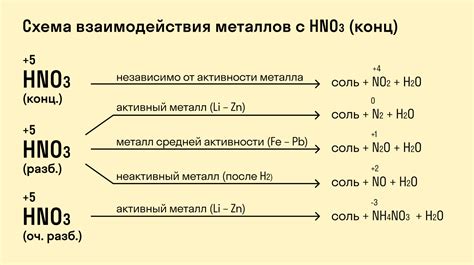
Взаимодействие металлов с концентрированными кислотами может приводить к различным химическим реакциям. Одним из наиболее известных примеров является реакция между железом и серной кислотой. При контакте железа с серной кислотой происходит образование сернистого ангидрида и водорода. Реакция может быть представлена уравнением:
Fe + H2SO4 → FeSO4 + H2
Еще одним примером взаимодействия металла с концентрированной кислотой является реакция между цинком и соляной кислотой. При контакте цинка с соляной кислотой образуется хлорид цинка и молекулярный водород. Уравнение данной реакции выглядит следующим образом:
Zn + 2HCl → ZnCl2 + H2
Кроме того, реакция между алюминием и серной кислотой также приводит к образованию соли алюминия и выделению водорода:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Это лишь несколько примеров реакций, которые могут происходить при взаимодействии металлов с концентрированными кислотами. Конкретные реакции зависят от свойств металла и кислоты, а также условий проведения эксперимента.
Влияние физических и химических свойств металлов на взаимодействие с концентрированными кислотами
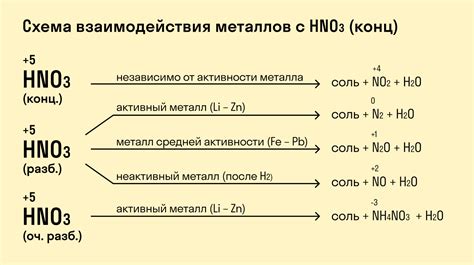
Физические и химические свойства металлов играют решающую роль в их взаимодействии с концентрированными кислотами. Наличие специфических свойств, таких как проводимость, пластичность и проводимость тепла, может оказывать влияние на процессы окисления и растворения металлов в кислотах.
Одним из важных факторов, влияющих на взаимодействие металлов с концентрированными кислотами, является их электрохимический потенциал. Металлы с более низким электрохимическим потенциалом, такие как алюминий и цинк, склонны к активному окислению и растворению в кислотных средах.
Также взаимодействие металлов с концентрированными кислотами может зависеть от их химической активности, которая определяется наличием свободных электронов в внешних энергетических уровнях атомов. Металлы с большим количеством свободных электронов, такие как натрий и калий, могут быть более активными в отношении концентрированных кислот и проявлять повышенную реакционную способность.
И последним важным фактором является степень кристалличности металла. Металлы с высокой степенью кристалличности, такие как железо и магний, обычно показывают меньшую реакционную способность по сравнению с металлами с низкой степенью кристалличности, такими как графит и аморфные сплавы.
В целом, физические и химические свойства металлов играют важную роль в взаимодействии с концентрированными кислотами и могут определять скорость и степень окисления и растворения металлов в таких средах.
Преимущества и недостатки использования металлов в условиях с концентрированными кислотами

Металлы широко применяются в различных областях, включая химическую промышленность и лаборатории. Однако их использование в условиях с концентрированными кислотами имеет как преимущества, так и недостатки.
Преимущества:
- Высокая прочность: большинство металлов обладает прочностью, что делает их стойкими к агрессивным воздействиям кислот.
- Термическая устойчивость: металлы способны выдерживать высокие температуры, что особенно важно при работе с концентрированными кислотами, которые могут обладать высоким кипением или требовать нагрева.
- Хорошая электропроводность: многие металлы обладают высокой электропроводностью, что позволяет использовать их для различных электрохимических процессов и устройств.
Недостатки:
- Коррозия: многие металлы подвержены коррозии при контакте с концентрированными кислотами, что может приводить к высоким затратам на замену и ремонт оборудования.
- Образование отложений: некоторые металлы могут образовывать отложения или осадки при взаимодействии с концентрированными кислотами, что может приводить к снижению производительности и качества процессов.
- Ограниченная совместимость: не все металлы совместимы с конкретными концентрированными кислотами, поэтому при выборе материала необходимо учитывать их совместимость для обеспечения безопасной эксплуатации.
В целом, использование металлов в условиях с концентрированными кислотами имеет свои преимущества и недостатки, и выбор оптимального материала должен учитывать требования процесса и условия работы.
Способы защиты металлов от взаимодействия с концентрированными кислотами

Взаимодействие металлов с концентрированными кислотами может привести к серьезным повреждениям и коррозии. Однако существуют различные способы защиты металлов от этого взаимодействия.
Один из основных способов защиты – использование пассивных слоев на поверхности металла. Эти слои образуются путем окисления или образования покрытия, которое предотвращает проникновение кислоты на поверхность металла. Например, в случае алюминия пассивным слоем может быть оксид алюминия, а в случае железа – оксид железа.
Другим способом защиты металлов является использование защитных покрытий. Нанесение на поверхность металла покрытий из полимеров, эмали или других материалов позволяет предотвратить проникновение кислоты на поверхность металла. Такие покрытия могут быть устойчивыми к действию кислот и обладать высокой химической стойкостью.
Также для защиты металлов от взаимодействия с концентрированными кислотами применяются специальные ингибиторы коррозии. Эти вещества добавляются в воду или другие жидкости, в которых происходит взаимодействие с металлами. Ингибиторы коррозии образуют на поверхности металла защитную пленку, которая предотвращает контакт кислоты с металлом и снижает скорость коррозии.
Для определения наиболее эффективных способов защиты металлов от взаимодействия с концентрированными кислотами необходимы тщательные исследования и испытания. Каждый конкретный случай требует индивидуального подхода и выбора наиболее подходящего метода защиты. Правильная защита металлов позволит снизить вероятность повреждений и увеличить их срок службы.
Вопрос-ответ

Какое химическое взаимодействие происходит между металлом и концентрированной кислотой?
Химическое взаимодействие между металлом и концентрированной кислотой основано на окислительно-восстановительных реакциях. Кислота действует как окислитель, отбирая электроны у металла, в результате чего металл окисляется. В свою очередь, металл действует как восстановитель, передавая свои электроны атомам кислорода вводимой в реакцию кислоты.
Какие металлы реагируют с концентрированными кислотами?
С различными концентрированными кислотами реагируют разные металлы. Например, щелочные металлы, такие как натрий и калий, реагируют с концентрированными кислотами, образуя соли и выделяя водород. Однако, не все металлы реагируют с концентрированными кислотами. Например, некоторые металлы, такие как серебро и золото, практически не реагируют с кислотами.
