Взаимодействие кислот с металлами является одной из важнейших химических реакций, которые происходят в природе и используются в промышленности. Металлы представляют собой элементы, которые способны легко отдавать электроны, а кислоты – составы, обладающие электрофильными свойствами. Когда кислота вступает в реакцию с металлом, происходит силовое взаимодействие, результатом которого является образование ионных соединений и выделение газа.
Процесс взаимодействия кислоты с металлом можно описать с помощью уравнения реакции, которое показывает, какие вещества участвуют в реакции и как они делятся между собой. Уравнение реакции кислоты с металлом записывается в виде:
Кислота + Металл → Ионное соединение + Выделение газа
В результате взаимодействия кислоты с металлом образуются ионные соединения, представленные солевыми комплексами, в которых металл занимает положение катиона, а анионом является отрицательно заряженное соединение. Помимо образования ионных соединений, во время реакции может происходить выделение газа, такого как водород или азот.
Взаимодействие кислот с металлами
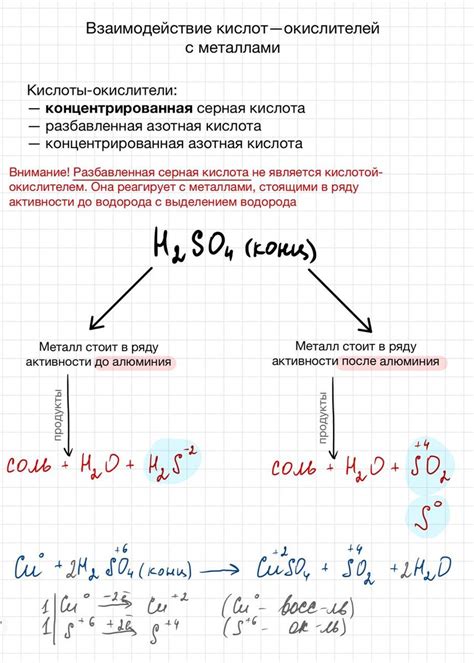
Взаимодействие кислот с металлами является одной из основных химических реакций, которые происходят в природе и используются в промышленности. Кислоты - это химические соединения, способные отдавать протоны (водородные ионы) при растворении в воде или взаимодействии с другими веществами. Металлы - это химические элементы, обладающие свойствами кондуктивности, относительной мягкости и блеска.
В процессе взаимодействия кислот с металлами происходят реакции окисления-восстановления, при которых кислоты получают электроны от металла и образуются соли и водород. Обычно такие реакции сопровождаются выделением газов, изменением цвета раствора и возможным выделением тепла.
Способность кислот исбывать металлы зависит от их силы и степени активности металла. Сильные кислоты, такие как соляная или серная, реагируют с большинством металлов, в то время как слабые кислоты, например, уксусная, реагируют только с некоторыми металлами. Металлы, находящиеся в верхних группах периодической таблицы, обычно реагируют более активно с кислотами.
Взаимодействие кислот с металлами имеет множество практических применений. Например, реакция соляной кислоты с металлами используется для получения хлорида металла, который может использоваться в различных отраслях промышленности. Также, взаимодействие кислот с металлами может применяться для очистки поверхностей металлических изделий или удаления ржавчины.
Уравнения реакций
Взаимодействие кислот с металлами является одним из наиболее распространенных и изучаемых типов химических реакций. Уравнения реакций позволяют описать протекание этих процессов и определить образующиеся продукты.
Основной принцип взаимодействия кислот с металлами заключается в образовании солей и выделении водорода. При этом, металл отдает свои электроны кислоте, что приводит к образованию ионов металла в соли, а водород выделяется в виде газа.
Например, реакция между кислотой серной (H2SO4) и металлом цинком (Zn) может быть представлена следующим уравнением:
| H2SO4 | + | Zn | = | ZnSO4 | + | H2 |
В результате этой реакции образуется соль цинка (ZnSO4) и выделяется молекулярный водород.
Уравнения реакций между кислотами и металлами могут быть представлены в различных формах, в зависимости от того, какие продукты образуются. Например, если взаимодействуют кислота сульфурной (H2SO4) и цинк (Zn), то можно составить следующее уравнение:
- 2H2SO4 + Zn = ZnSO4 + 2H2O + SO2
В данном случае, в результате реакции образуется соль цинка (ZnSO4), вода (H2O) и диоксид серы (SO2).
Таким образом, уравнения реакций между кислотами и металлами позволяют наглядно представить протекание этих процессов и определить образующиеся продукты.
Влияние концентрации на ход реакции

Концентрация реагентов является одним из факторов, влияющих на ход химической реакции между кислотой и металлом. Увеличение концентрации реагентов может привести к ускорению реакции или повышению ее эффективности. Одна из основных причин такого влияния заключается в увеличении количества активных частиц, способных вступать в химическую реакцию.
На примере реакции между кислотой и металлом можно рассмотреть влияние концентрации одного из реагентов. При увеличении концентрации кислоты можно ожидать более интенсивного химического взаимодействия с металлом. Это связано с тем, что увеличение концентрации кислоты приводит к увеличению количества ионов в растворе, что ускоряет процесс реакции.
Однако, не всегда повышение концентрации реагентов влияет положительно на ход реакции. В некоторых случаях, высокая концентрация кислоты может привести к образованию пассивной пленки на поверхности металла, что затрудняет химическое взаимодействие и замедляет реакцию.
Таким образом, концентрация кислоты и металла играет важную роль в химической реакции между ними. Оптимальная концентрация реагентов может быть достигнута путем проведения предварительных экспериментов и определения оптимальных условий для проведения реакции.
Факторы, влияющие на скорость реакции

Скорость химической реакции – это изменение концентрации вещества за единицу времени. Она может значительно варьироваться в зависимости от ряда факторов, влияющих на процесс взаимодействия реагентов. Рассмотрим основные из них.
1. Концентрация реагентов. Чем выше концентрация реагентов, тем больше их молекул будет сталкиваться между собой и, соответственно, увеличится вероятность реакции. Повышение концентрации ускоряет процесс, тогда как снижение его замедляет.
2. Температура среды. Повышение температуры приводит к увеличению энергии молекул, что делает их столкновения более эффективными. Таким образом, реакция протекает быстрее при повышенной температуре, а при пониженной – замедляется.
3. Физическое состояние реагентов. Реакция протекает быстрее, если реагенты находятся в одной фазе (газе, жидкости или твердом состоянии), так как молекулы могут свободно перемещаться и сталкиваться между собой. В случае, если реагенты находятся в разных фазах, реакция протекает медленнее или вообще не происходит.
4. Катализаторы. Некоторые вещества (катализаторы) способны ускорять химическую реакцию, не участвуя в ней. Они обладают способностью понижать энергию активации реакции, тем самым ускоряя ее протекание. Наличие катализаторов может существенно повлиять на скорость реакции.
5. Поверхность контакта реагентов. Если площадь поверхности контакта реагентов большая, то сталкиваться между собой будет больше молекул, что способствует ускорению реакции. В случае с твердыми реагентами, мелкое измельчение поверхности позволяет повысить скорость реакции.
Вопрос-ответ

Какие бывают типы взаимодействия кислот с металлами?
Существуют различные типы взаимодействия кислот с металлами, такие как образование гидроксидов металлов, образование солей металлов и выделение водорода.
Какие уравнения реакций возникают при взаимодействии кислот с металлами?
При взаимодействии кислот с металлами возникают различные уравнения реакций в зависимости от кислоты и металла. Например, при реакции соляной кислоты с цинком образуется соль и выделяется водород: 2HCl + Zn -> ZnCl2 + H2.
Как происходит реакция кислоты с металлами?
Реакция кислоты с металлами происходит путем обмена ионами между кислотой и металлом. Кислота отдает протон, образуя положительный ион, а металл отдает электроны, образуя положительный ион. Эти ионы образуют соль и выделяются водородные ионы.
Какие металлы реагируют с кислотами?
Реакция металлов с кислотами зависит от их активности. Активные металлы, такие как натрий, калий и магний, реагируют с большинством кислот, например соляной кислотой или серной кислотой. Менее активные металлы, такие как железо или цинк, обычно реагируют только с сильными кислотами.
