Комплексные соединения металлов широко используются в химии, благодаря своим уникальным физико-химическим свойствам. Однако, помимо комплексных соединений, существует огромное разнообразие реакций, в которых металлы могут участвовать без образования комплексов. Эти реакции представляют большой интерес как для теоретической химии, так и для практического применения.
В одном из классов таких реакций металл может претерпеть окисление или восстановление без образования комплексного соединения. Это связано с возможностью металлов принимать различные степени окисления. Например, железо может восстанавливать оксиды, образуя при этом соответствующие соли, или окисляться в более высоких окислительных состояниях. Такие реакции широко применяются в различных синтетических процессах и в разработке электрохимических устройств.
Еще одной интересной группой реакций являются протекание реакций с образованием межметаллических соединений. В этом случае два различных металла могут взаимодействовать между собой, образуя новое соединение с определенной структурой и свойствами. Например, при взаимодействии перекиси водорода с палладием образуется палладиева синеглазка, которая широко используется в каталитических процессах.
Таким образом, реакции без участия комплексных соединений металлов представляют собой важный класс химических превращений, который открывает массу новых возможностей для использования металлов в различных сферах науки и технологии. Исследование и развитие этих реакций может привести к разработке новых материалов, каталитических процессов и электрохимических устройств, что даст новый толчок в развитии различных отраслей промышленности и научных исследований.
Неорганические соединения как активаторы
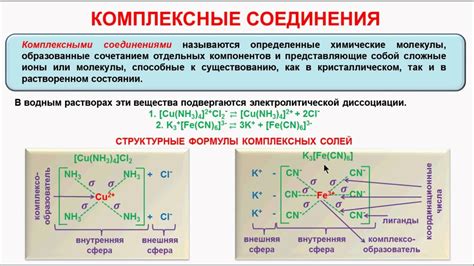
Неорганические соединения играют важную роль в качестве активаторов реакций без участия комплексных соединений металлов. Они могут ускорять реакции, манипулировать их кинетикой и выбирать конкретные продукты.
Одним из наиболее широко распространенных классов активаторов являются кислоты и основания. Катионы и анионы этих соединений участвуют в протонных и гидроксильных реакциях, что влияет на скорость и направление реакции без участия комплексных соединений металлов.
Также в качестве активаторов используются окислители и восстановители. Они могут изменять окислительно-восстановительный потенциал системы, что приводит к изменению термодинамической стабильности реакционных комплексов.
Неорганические соединения могут также служить координирующими агентами, образуя комплексы с реагентами и катализируя их превращение. Это позволяет ускорить химическую реакцию, создавать специфичные активные центры и контролировать стереохимию продуктов.
Таким образом, неорганические соединения являются важными активаторами реакций без участия комплексных соединений металлов, позволяя контролировать и ускорять процессы химических превращений.
Органические соединения в качестве катализаторов

Катализаторы являются одной из ключевых компонент реакций без участия комплексных соединений металлов. Катализаторы, в отличие от реагентов, не участвуют непосредственно в химической реакции, но способствуют ее протеканию, снижая энергию активации.
В качестве катализаторов широко применяются органические соединения, такие как ферменты, органические кислоты, щелочи, аминокислоты и другие. Они обладают высокой активностью и способностью увеличить скорость реакции без участия металлов.
Органические соединения могут выполнять роль кислот или оснований, которые активируют реагенты, повышают их реакционную способность и стабилизируют промежуточные состояния. Например, в реакциях эстерификации органические кислоты могут использоваться в качестве катализаторов, способствуя образованию эстеров.
Также, органические соединения могут обладать специфичной структурой, которая позволяет им эффективно ускорять химические реакции. Например, ферменты – это белковые катализаторы, которые обладают уникальной третичной структурой и специфической активной центральной позицией. Они обеспечивают интенсивную трансформацию субстратов и широкий спектр реакций.
Фотохимические реакции без металлов

Фотохимические реакции - это процессы, которые происходят под воздействием света. Они не требуют участия комплексных соединений металлов и могут протекать на основе органических или неорганических веществ. Эти реакции происходят благодаря взаимодействию световой энергии с молекулами вещества.
Одной из известных фотохимических реакций без металлов является фотосинтез - процесс, при котором зеленые растения используют энергию света для превращения углекислого газа и воды в органические вещества, такие как глюкоза и кислород. Эта реакция не только позволяет растениям получать энергию для своего роста и развития, но и освобождает кислород, необходимый для дыхания живых организмов.
Еще одной фотохимической реакцией без металлов является образование озона в стратосфере под воздействием ультрафиолетовых лучей Солнца. Ультрафиолетовые лучи разрывают молекулы кислорода, а затем образованные атомы кислорода реагируют с другими молекулами кислорода, образуя озон. Озон служит защитой от вредного ультрафиолетового излучения, которое может вызывать рак кожи и другие проблемы со здоровьем.
Важным примером фотохимической реакции без металлов является фотокаталитическое окисление воздуха, осуществляемое титановыми диоксидными катализаторами. Под действием света, эти катализаторы могут окислять различные загрязнители в воздухе, такие как диоксид азота или формальдегид, и превращать их в менее вредные соединения.
Таким образом, фотохимические реакции без участия комплексных соединений металлов представляют широкий спектр возможностей в различных сферах - от растительного мира до охраны окружающей среды.
Элементарные реакции без вмешательства металлов

В мире химии существует широкий спектр элементарных реакций, которые не требуют участия комплексных соединений металлов. Эти реакции возможны благодаря взаимодействию различных веществ, включая органические и неорганические соединения.
Одной из таких реакций является реакция окисления-восстановления, где происходит передача электронов между веществами. Эта реакция может происходить самопроизвольно без присутствия металлов в качестве катализаторов или активных участников. В результате реакции возникают окисленное и восстановленное вещества.
Еще одним примером элементарной реакции без участия металлов является реакция нуклеофильного замещения, которая происходит между нуклеофилом и электрофилом. В этой реакции нуклеофил отдает пару электронов электрофилу, что приводит к образованию нового соединения.
Органическая химия также предлагает много элементарных реакций, в которых металлы не являются необходимыми. Например, реакция алифатической замены, где один атом замещается другим, или реакция иммиссии, где происходит встраивание молекулы в другую молекулу без участия металлов.
В итоге, элементарные реакции без участия комплексных соединений металлов представляют широкий круг возможностей для синтеза и превращения различных веществ. Изучение этих реакций позволяет расширить наши знания о мире химии и открыть новые методы синтеза и применения веществ в различных областях науки и технологий.
Вопрос-ответ

Какие реакции металлов могут происходить без участия комплексных соединений?
Различные реакции металлов без участия комплексных соединений могут быть классифицированы как реакции окисления-восстановления, реакции с кислотами и щелочами, реакции с веществами с донорными или акцепторными свойствами электронов, а также реакции с органическими соединениями.
Как происходят реакции окисления-восстановления?
В реакциях окисления-восстановления одно вещество окисляется, то есть отдает электроны, а другое вещество восстанавливается, принимая электроны. Примером такой реакции может быть реакция железа с кислородом, где железо окисляется, а кислород восстанавливается.
