Периодическая система элементов представляет собой удобное средство для классификации химических элементов и понимания их свойств. Одной из ключевых характеристик элементов является их атомный радиус - расстояние от ядра атома до его внешней электронной оболочки. Оказывается, увеличение заряда ядра от щелочного металла к галогену ведет к увеличению радиуса атомов в элементах 3-го периода.
Щелочные металлы, такие как литий, натрий и калий, имеют низкий заряд ядра и, соответственно, маленький атомный радиус. Это объясняется тем, что в атомах этих элементов мало электронов, которые экранируют положительный заряд ядра. Таким образом, притяжение между электронами и ядром сильнее, что делает атомы более компактными.
С другой стороны, галогены, такие как фтор, хлор и бром, имеют высокий заряд ядра и, следовательно, большой атомный радиус. У этих элементов много электронов, которые оказывают слабое экранирующее действие на ядро. В результате притяжение между электронами и ядром ослабевает, и атомы становятся более разреженными.
Таким образом, увеличение заряда ядра от щелочного металла к галогену приводит к изменению атомного радиуса элементов 3-го периода. Это важное свойство помогает понять ряд химических и физических свойств периодической системы элементов и является основой для дальнейших исследований и открытий в химии и материаловедении.
Радиусы атомов в 3м периоде
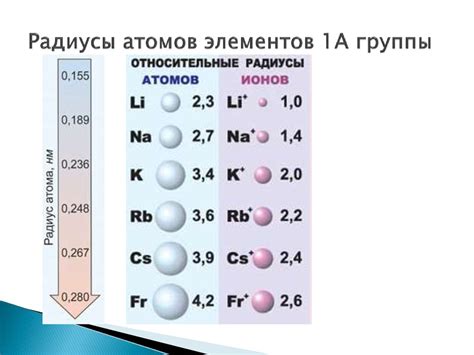
В 3м периоде периодической системы элементов находятся атомы щелочных металлов и галогенов. Радиус атома - это половина расстояния между ядрами связанных атомов в молекуле элемента. Он позволяет оценить размер атома, его объем и способность взаимодействовать с другими атомами.
Щелочные металлы в 3м периоде, такие как натрий, магний и алюминий, имеют атомы сравнительно большого размера. Это связано с тем, что они имеют резко выраженный металлический характер свойств и образуют металлическую решетку, где атомы группируются в кристаллическую решетку. Благодаря этому их атомы обладают большим радиусом и объемом по сравнению с атомами галогенов.
Атомы галогенов, таких как хлор, бром и йод, имеют значительно меньший радиус по сравнению с щелочными металлами. Это связано с тем, что галогены образуют молекулы, состоящие из двух атомов. Благодаря этому атомы галогенов в молекуле с тем же количеством электронов остаются ближе друг к другу, что приводит к уменьшению их радиуса по сравнению с атомами щелочных металлов.
Таким образом, при увеличении заряда ядра от щелочного металла к галогену, радиусы атомов в 3м периоде уменьшаются. Это объясняется различными способами образования связей и молекул у этих элементов.
Радиус и его значимость

Радиус атома - это физическая величина, которая характеризует размер атома и определяет его объем. Размер атома очень важен для понимания его химических свойств и взаимодействий с другими атомами.
Влияние радиуса атома на его свойства проявляется в различных аспектах. Во-первых, радиус атома определяет силу притяжения между ядром и электронами. Чем больше радиус, тем слабее эта притяжение, что ведет к более легкому отрыву электронов и, следовательно, более активным химическим свойствам.
Во-вторых, радиус атома влияет на электронную оболочку. Больший радиус атома позволяет иметь больше электронных оболочек и большее количество электронов в оболочках. Это приводит к возможности образования большего числа связей с другими атомами и, следовательно, к большей химической активности.
Одной из явных иллюстраций влияния радиуса является увеличение радиуса атомов 3-го периода при увеличении заряда ядра от щелочного металла к галогену. У щелочных металлов, таких как литий и натрий, которые имеют низкий заряд ядра, радиусы атомов относительно большие. В то же время, у галогенов, таких как фтор и хлор, с высоким зарядом ядра, радиусы меньше. Это объясняется увеличением притяжения между ядром и электронами и сжатием электронных оболочек.
Знание радиуса атома и его влияния на химические свойства является основополагающим для окончательного понимания и описания химического поведения и реакций атомов. Использование радиуса атома позволяет предсказывать и объяснять различные химические свойства веществ и взаимодействия между ними.
Влияние заряда ядра
Заряд ядра атома - это количество протонов, находящихся в ядре атома. Он представляет собой основную характеристику атома, определяющую его свойства и поведение в химических реакциях. Влияние заряда ядра на радиус атомов 3-го периода может быть наблюдено при сравнении элементов, принадлежащих этому периоду и имеющих разные заряды ядер.
Увеличение заряда ядра от щелочного металла к галогену приводит к изменению радиусов атомов. Щелочные металлы имеют наименьший заряд ядра в данном периоде, поэтому их атомы имеют наибольший радиус. Галогены, напротив, имеют наибольший заряд ядра, поэтому их атомы имеют наименьший радиус. Это связано с электростатическим притяжением между ядром и электронами, которое зависит от заряда ядра.
Увеличение заряда ядра приводит к усилению электростатического притяжения между ядром и электронами в атоме. В результате этого притяжения электроны сжимаются ближе к ядру, что приводит к уменьшению радиуса атома. Чем больше заряд ядра, тем сильнее притяжение и тем компактнее будет атом. При увеличении заряда ядра от щелочного металла к галогену, радиусы атомов являются убывающей функцией этого заряда.
Таблица ниже показывает изменение радиусов атомов элементов 3-го периода в зависимости от заряда ядра:
| Элемент | Заряд ядра | Радиус атома |
|---|---|---|
| Натрий (Na) | 11 | 186 пм |
| Магний (Mg) | 12 | 160 пм |
| Алюминий (Al) | 13 | 143 пм |
| Кремний (Si) | 14 | 132 пм |
| Фосфор (P) | 15 | 128 пм |
| Сера (S) | 16 | 127 пм |
| Хлор (Cl) | 17 | 99 пм |
| Аргон (Ar) | 18 | 97 пм |
Таким образом, можно установить закономерность между зарядом ядра и радиусом атомов 3-го периода. Увеличение заряда ядра от щелочного металла к галогену приводит к уменьшению радиуса атомов и усилению электростатического притяжения с ядром.
Особенности щелочных металлов

Щелочные металлы являются первой группой периодической системы и включают элементы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются рядом особенностей, которые делают их уникальными среди других элементов.
- Низкая плотность и высокая твердость: Щелочные металлы обладают низкой плотностью, что делает их легкими и подвижными. Одновременно с этим, они обладают высокой твердостью, что делает их прочными и устойчивыми к истиранию.
- Высокая реактивность: Щелочные металлы очень реактивны и быстро окисляются воздухом. Их сильные основания и химические свойства позволяют им образовывать кислоты и растворяться в воде с выделением водорода.
- Низкая электроотрицательность и высокая ионизационная энергия: Щелочные металлы имеют низкую электроотрицательность и высокую ионизационную энергию. Это делает их хорошими источниками электронов и ионов, что позволяет им участвовать во множестве химических реакций.
Другими особенностями щелочных металлов являются их способность образовывать легкосольные соединения и высокая электропроводность. Щелочные металлы также широко используются в промышленности и научных исследованиях благодаря своим отличным химическим свойствам и способности образовывать стабильные соединения с другими элементами.
Особенности галогенов

Галогены - это группа химических элементов, включающая фтор, хлор, бром, иод и астат. Они относятся к 17-й группе периодической системы элементов и известны своей высокой реакционностью. Галогены имеют следующие особенности:
- Реакционность: Галогены являются сильными окислителями и могут вступать в реакции с большим числом других веществ. Они легко образуют соли с щелочными металлами и многие другие соединения.
- Токсичность: Большинство галогенов, таких как хлор и бром, являются ядовитыми веществами. Они могут вызывать раздражение глаз, кожи и дыхательных путей, а также серьезные отравления при попадании в организм человека.
- Физические свойства: Галогены имеют отличные физические свойства. Они обычно представляют собой газы или жидкости при комнатной температуре и давлении, с высокими точками кипения и плавления.
- Использование: Галогены широко используются в промышленности и научных исследованиях. Например, хлор используется для производства пластмасс, хлороорганических соединений и промышленных реагентов.
- Биологическое значение: Галогены играют важную роль в биологических системах. Например, йод является необходимым микроэлементом для правильного функционирования щитовидной железы и синтеза гормонов щитовидной железы.
Галогены обладают уникальными свойствами, которые делают их неотъемлемой частью химии и науки в целом. Их химическая активность и присутствие во многих важных соединениях и процессах делает их предметом постоянного исследования и изучения.
Вопрос-ответ

Каким образом увеличивается радиус атомов 3 го периода при увеличении заряда ядра от щелочного металла к галогену?
При увеличении заряда ядра от щелочного металла к галогену, радиус атомов 3 го периода увеличивается. Это происходит из-за увеличения электростатического отталкивания между электронами и ядром. Поскольку заряд ядра увеличивается, притяжение электронов к ядру становится сильнее, что приводит к увеличению размера атома.
Почему радиус атомов 3 го периода увеличивается при увеличении заряда ядра от щелочного металла к галогену?
Увеличение радиуса атомов 3 го периода при увеличении заряда ядра от щелочного металла к галогену обусловлено тем, что с увеличением заряда ядра возрастает притяжение электронов к ядру. Это влияет на электронную оболочку атома, которая расширяется, чтобы уменьшить электростатическое отталкивание между электронами и ядром. В результате, радиус атома увеличивается.
Как зависит радиус атомов 3 го периода от заряда ядра?
Радиус атомов 3 го периода зависит от заряда ядра. При увеличении заряда ядра от щелочного металла к галогену, радиус атомов увеличивается. Это происходит из-за увеличения притяжения электронов к ядру и увеличения электростатического отталкивания между электронами и ядром. Увеличение заряда ядра приводит к более сильному притяжению электронов и, как следствие, к увеличению размера атома.
Почему при увеличении заряда ядра радиус атомов 3 го периода увеличивается?
Радиус атомов 3 го периода увеличивается при увеличении заряда ядра, потому что с увеличением заряда ядра увеличивается притяжение электронов к ядру. Это влияет на электронную оболочку атома, которая начинает расширяться, чтобы уменьшить электростатическое отталкивание между электронами и ядром. Таким образом, увеличение заряда ядра приводит к увеличению размера атома в данном периоде.
