Разложение веществ при нагревании является одним из важнейших процессов в химии. Этот процесс заключается в разрушении молекул, атомов или ионов соединений при повышении температуры. Одним из типичных примеров является разложение веществ с образованием оксида металла. К данной группе веществ относятся металлы, образующие оксиды при нагревании.
Разложение с образованием оксида металла является эндотермическим процессом, то есть процессом, при котором поглощается тепловая энергия. В результате разложения происходит выделение кислорода, который присоединяется к металлу, образуя оксид. Этот процесс обратим и может протекать в обратном направлении, если изменить условия, например, снизить температуру.
Процессы разложения веществ при нагревании с образованием оксида металла имеют важное практическое значение. Они используются в производстве разных материалов и продуктов. В частности, такие процессы применяются при получении металлов, керамики, стекла и других материалов. Благодаря этим процессам, ученые и инженеры получают различные материалы с нужными свойствами, которые применяются в разных отраслях промышленности и строительства.
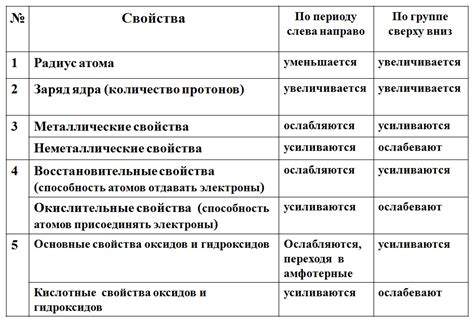
Процессы разложения веществ

Разложение веществ представляет собой процесс разделения сложных химических соединений на простые компоненты под воздействием различных физических или химических факторов. Одним из таких факторов является нагревание, которое может привести к образованию оксида металла.
При нагревании вещества происходит увеличение его внутренней энергии, что приводит к разрыву химических связей и образованию новых соединений. Такой процесс разложения может происходить как с одним веществом, так и с смесью нескольких веществ.
Разложение вещества при нагревании с образованием оксида металла может иметь различные причины. Например, при нагревании металлических оксидов происходит выделение кислорода, который связывается с металлом, образуя оксид. Также возможно разложение органических веществ с образованием оксида углерода.
Для контроля процессов разложения веществ при нагревании проводятся специальные эксперименты. Они позволяют изучить температурные условия, при которых происходит разложение, а также определить состав и свойства образованных оксидов металлов.
Важной задачей исследования разложения веществ является проведение анализа полученных результатов. Это позволяет установить закономерности и особенности процессов разложения веществ, а также определить их возможное применение в различных областях науки и техники.
Реакции оксидации металлов

Реакции оксидации металлов являются важным аспектом изучения процессов разложения веществ при нагревании. Оксидация представляет собой химическую реакцию, в результате которой происходит образование оксида металла.
Оксиды металлов обладают различными свойствами. В зависимости от условий реакции и соотношения реагентов могут образовываться различные виды оксидов. Некоторые оксиды металлов могут иметь кислотные свойства, например оксиды неметаллов, такие как оксид серы и оксид азота. В то же время, другие оксиды металлов обладают щелочными свойствами, например оксиды щелочных металлов, такие как оксид натрия и оксид калия.
Реакции оксидации металлов происходят под воздействием высокой температуры. При нагревании металлов с кислородом происходит образование оксидов металлов. Например, при нагревании алюминия с кислородом, образуется оксид алюминия. Реакция оксидации металлов является экзотермической, то есть сопровождается выделением тепла.
Реакции оксидации металлов имеют широкое практическое применение. Они используются в процессе получения металлов из их руд, в производстве шлаков, керамики и других материалов. Знание реакций оксидации металлов позволяет понять особенности их превращений при нагревании и использовать эти знания в различных технологических процессах.
Изменение физических свойств
При нагревании вещества и последующем процессе разложения с образованием оксида металла происходят значительные изменения его физических свойств.
Во-первых, происходит изменение состояния вещества. При нагревании многие вещества переходят из твердого состояния в жидкое или газообразное. Например, оксиды многих металлов при нагревании становятся жидкими или газообразными соединениями.
Во-вторых, меняются физические свойства вещества, такие как плотность, вязкость и теплоемкость. Например, оксиды металлов при нагревании обычно становятся менее плотными, что связано с увеличением расстояния между атомами или ионами вещества.
Изменение физических свойств вещества при процессе разложения с образованием оксида металла может использоваться в различных областях, например, в промышленности для получения металлических оксидов или в химических лабораториях для изучения свойств вещества при различных температурах.
Образование соединений с кислородом

При нагревании металлических веществ наблюдается процесс образования соединений с кислородом, которые обычно являются оксидами металлов. Это происходит из-за высокой реакционной способности кислорода.
В результате окислительных реакций, происходящих при нагревании, металлы связываются с кислородом и образуют соединения с формулами, в которых указывается содержание кислорода. Например, образование оксида марганца, MnO, или оксида алюминия, Al2O3.
Образование соединений с кислородом при нагревании является характерным свойством металлов и часто используется в химических процессах и промышленности для получения оксидов металлов.
Оксиды металлов имеют различные свойства и применяются в разных отраслях. Например, оксид железа, Fe2O3, обладает магнитными свойствами и используется в производстве магнитов. Оксид кальция, CaO, известен как известь и применяется в строительной и сельском хозяйстве.
Все оксиды металлов обладают высокой теплостойкостью, что делает их полезными при производстве огнеупорных материалов. Они также широко используются в процессах оксидации и восстановления, а также при производстве керамики и стекла.
Термический распад веществ

Термический распад веществ – это процесс разложения химических соединений под воздействием высокой температуры, который сопровождается образованием оксида металла. При нагревании соединение постепенно распадается на металлический оксид и другие продукты.
Термический распад является важной реакцией, которая может протекать в различных условиях. Он может происходить как в промышленности, например, в процессе получения металлов, так и в природе, при геологических и геохимических процессах.
При нагревании вещества происходят сложные физические и химические изменения. В начале процесса распада вещества происходит изменение структуры молекул, затем происходит разрыв химических связей и образование новых веществ.
В результате термического распада происходит образование оксида металла. Это важный процесс, так как оксиды металлов широко используются в разных отраслях промышленности, включая производство керамики, стекла, металлургию и другие. Они также являются важными компонентами в различных химических реакциях и процессах.
Аллотропия металлов
Аллотропия – это свойство некоторых веществ принимать различные физические формы при разных условиях. Металлы также имеют свои разновидности, называемые аллотропами.
Аллотропные формы металлов отличаются друг от друга как физическими свойствами, так и химической активностью. Например, кристаллы аллотропной формы могут иметь различные корпускулярные структуры и существенно отличаться по плотности, твердости и плавлению.
Одним из наиболее известных примеров аллотропии металлов является кислород – аллотропная форма кислорода, которая обладает более низкой плотностью и более высокой твердостью, чем обычный кислород воздуха.
Аллотропия может быть использована для изменения физических и химических свойств металлов, что позволяет создавать новые материалы с улучшенными характеристиками. Например, при добавлении аллотропной формы металла в сплав, можно значительно повысить его прочность и твёрдость.
Химические свойства оксидов металлов
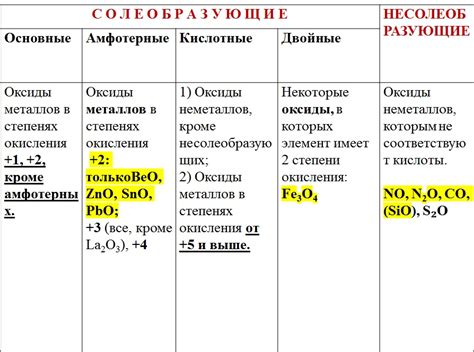
Оксиды металлов - это вещества, состоящие из металлических и кислородных атомов. Они обладают рядом химических свойств, которые определяют их роль в природе и промышленности.
Во-первых, оксиды металлов обычно обладают основным характером. Они реагируют с кислотами, образуя соли и воду. Например, оксид железа (III) образует растворимые соли железа (III) при взаимодействии с кислородными кислотами.
Во-вторых, оксиды металлов обычно растворяются в кислотах. Это объясняется тем, что оксиды металлов могут реагировать с водой и образовывать кислоты. Например, оксид алюминия реагирует с водой, образуя кислоту алюминиевую и выделяя тепло.
В-третьих, некоторые оксиды металлов обладают амфотерными свойствами, то есть они могут проявлять как основный, так и кислотный характер. Например, оксиды железа могут реагировать как с кислотами, так и с щелочами.
Кроме того, оксиды металлов могут быть окислителями или восстановителями. Например, оксид меди (II) является окислителем, так как обладает способностью принимать лишние электроны от других веществ. В то же время, оксид железа (III) является восстановителем, так как способен отдавать электроны другим веществам.
Таким образом, оксиды металлов имеют разнообразные химические свойства, обусловленные атомной структурой и электронной конфигурацией металлических элементов. Эти свойства широко используются в различных областях промышленности и научных исследований.
Вопрос-ответ

Какие процессы происходят при нагревании веществ с образованием оксида металла?
При нагревании веществ происходят различные процессы разложения, в результате которых образуется оксид металла. Один из таких процессов – окисление металла в присутствии кислорода. К примеру, при нагревании железа происходит процесс окисления, при которым образуется оксид железа. Также может происходить декомпозиция вещества с образованием оксида металла, когда при нагревании вещество распадается на составные части и одной из них является оксид металла.
Какие оксиды металла могут образовываться при нагревании?
При нагревании веществ могут образовываться различные оксиды металла, в зависимости от состава и свойств исходного вещества. Например, в результате окисления железа образуется оксид железа (III) – Fe2O3. Алюминий при нагревании образует оксид алюминия – Al2O3. Варьирование условий нагревания (температура, давление, присутствие других веществ и т.д.) может влиять на образующийся оксид металла.
Какие факторы влияют на процессы образования оксида металла при нагревании?
На процессы образования оксида металла при нагревании влияют различные факторы. Один из важных факторов – наличие или отсутствие кислорода в окружающей среде. Если при нагревании вещества отсутствует кислород, то образуется меньше оксида металла или могут образовываться другие соединения. Также важным фактором является температура нагревания – при разных температурах происходят различные процессы разложения веществ с образованием оксида металла.
Можно ли использовать процессы образования оксида металла при нагревании в промышленности?
Да, процессы образования оксида металла при нагревании могут быть использованы в различных отраслях промышленности. Например, образование оксида металла может быть важным этапом в получении металлургических продуктов или использоваться в процессах катализа. Также некоторые оксиды металлов используются в качестве красителей, пигментов или добавок в материалах.
