Соли азотной кислоты легких металлов – это вещества, получаемые при реакции этих металлов с азотной кислотой. Разложение таких солей является важным физико-химическим процессом, обладающим своими особенностями и применением в различных отраслях науки и техники.
Основной особенностью разложения солей азотной кислоты легких металлов является выделение диоксида азота. При взаимодействии соли с кислотой, металлный ион отдает свои электроны кислотному иону, образуя соединение с кислородом. В результате разложения образуется диоксид азота, который активно используется в различных процессах, включая производство химических соединений и использование в качестве окислителя в ракетных двигателях.
Кроме того, разложение солей азотной кислоты легких металлов может применяться в качестве метода синтеза важных химических соединений. Например, азотнокислый аммоний NH4NO3 является высокоэнергичным веществом и используется при производстве взрывчатых веществ. Разложение этой соли позволяет получить азотную кислоту HNO3 и аммиак NH3, которые затем могут быть использованы для дальнейшего синтеза других соединений.
Что такое разложение солей

Разложение солей - это химическая реакция, в ходе которой соль, содержащаяся в растворе или твердом состоянии, распадается на два или более компонента. Разложение солей может происходить при воздействии высоких температур, света, электрического тока или химических реагентов. Этот процесс основан на изменениях в структуре и связях между атомами в молекулах соли.
Разложение солей является важной реакцией в химической индустрии и научных исследованиях. Оно широко применяется для получения различных продуктов, таких как кислоты, основания, металлы и другие соединения. Кроме того, разложение солей может быть использовано для анализа состава и свойств солей, что позволяет определить их химическую формулу и степень чистоты.
Разложение солей азотной кислоты легких металлов, таких как натрий и калий, является особенным случаем разложения солей. В результате этой реакции образуются оксиды металлов и оксид азота. Этот процесс широко применяется в производстве удобрений, взрывчатых веществ и других химических продуктов.
Определение и процесс

Разложение солей азотной кислоты легких металлов - это химический процесс, при котором соли, содержащие азотную кислоту и легкие металлы, распадаются на элементы, образуя соответствующие оксиды и азотные оксиды.
Этот процесс происходит при нагревании солей в присутствии кислорода или воздуха. В результате разложения образуются оксиды металлов, а также азотные оксиды, такие как оксид азота (NO) или диоксид азота (NO2).
Разложение солей азотной кислоты легких металлов имеет более сложные последствия, чем разложение солей других кислот. Вследствие высокой реакционной способности азотной кислоты, этот процесс может протекать с выделением значительного количества тепла и газов, что требует особой осторожности при его проведении.
Применение разложения солей азотной кислоты легких металлов находит в различных областях. Оно может использоваться в процессе получения оксидов и азотных оксидов для использования в производстве разнообразных продуктов, включая удобрения, взрывчатые вещества и катализаторы. Кроме того, этот процесс может применяться в лабораторных исследованиях для получения нужных соединений или для изучения свойств и реакций различных веществ.
Соли азотной кислоты

Соли азотной кислоты являются классом соединений, состоящих из катиона металла и аниона азотной кислоты. Они широко используются в различных областях, включая промышленность, сельское хозяйство и медицину.
В промышленности соли азотной кислоты применяются в процессе производства удобрений, взрывчатых веществ и других химических соединений. Крупные промышленные компании используют их для синтеза азотной кислоты и аммиака, которые являются основными компонентами удобрений.
В сельском хозяйстве соли азотной кислоты используются для повышения урожайности посевов. Они способствуют активному росту растений и улучшают их питательное состояние. Кроме того, эти соединения помогают улучшить почву, воздействуя на ее структуру и увеличивая содержание необходимых нутриентов.
В медицине соли азотной кислоты широко используются в качестве противомикробного и противовоспалительного средства. Они способны уничтожать бактерии и предотвращать развитие инфекций. Кроме того, эти соединения применяются в некоторых лекарственных препаратах для лечения заболеваний, связанных с повышенным уровнем кислотности в желудке.
В целом, соли азотной кислоты являются важными соединениями, имеющими широкий спектр применения в различных отраслях. Они играют ключевую роль в промышленности, сельском хозяйстве и медицине, способствуя улучшению производственных процессов, повышению урожайности и улучшению здоровья людей.
Особенности легких металлов

Легкие металлы – это группа элементов, которые обладают низкой плотностью и относительно низкой температурой плавления и кипения. В эту группу входят металлы такие, как литий, натрий, калий и магний. Они часто используются в различных отраслях промышленности и научных исследованиях.
Одной из особенностей легких металлов является их низкая плотность, что делает их легкими и пригодными для использования в различных конструкциях и изделиях, где важен вес материала. Например, алюминий, который является одним из самых распространенных легких металлов, используется в авиационной и автомобильной промышленности для создания легких и прочных деталей.
Еще одной особенностью легких металлов является их высокая химическая активность. Натрий и калий, например, активно реагируют с водой, образуя щелочные растворы. Это свойство находит применение в различных химических процессах, включая производство щелочей и гидрогенирование органических соединений.
Легкие металлы также обладают высокой теплопроводностью и электропроводностью. Это делает их идеальными материалами для использования в различных электронных устройствах, таких как компьютеры, мобильные телефоны и другие промышленные и бытовые приборы. Они также широко применяются в производстве батарей, так как способны обеспечивать высокую энергетическую плотность.
Еще одной важной особенностью легких металлов является их способность образовывать сплавы с другими металлами. Например, алюминий часто используется в сплавах с медью, цинком, магнием и др. Это позволяет создавать материалы с новыми свойствами, такими как повышенная прочность или коррозионная стойкость. Это делает легкие металлы универсальными и востребованными в различных отраслях промышленности.
Механизм разложения

Разложение солей азотной кислоты легких металлов происходит в результате термического разложения, которое является эндотермическим процессом. При нагревании солей азотной кислоты, молекулы кислоты разлагаются на оксид азота и воду. В процессе образования оксида азота происходит окисление легких металлов, таких как натрий, калий или кальций.
Механизм разложения солей азотной кислоты легких металлов можно представить следующим образом. Сначала происходит отделение ангидрида азотной кислоты от металла, при этом выделяется диоксид азота. Затем диоксид азота взаимодействует с водой, образуя азотистую кислоту и оксигидрат легкого металла. Оксигидрат далее диспропорционирует, образуя оксид металла и гидроксид металла.
Такой механизм разложения солей азотной кислоты легких металлов обусловлен их более высокой активностью и реакционной способностью. Например, натрий, калий и кальций относятся к активным металлам, которые легко реагируют с кислотами. Разложение солей азотной кислоты легких металлов может быть использовано в различных промышленных процессах, например, при получении оксида натрия, который широко применяется в стекольной промышленности.
Процессы и реакции
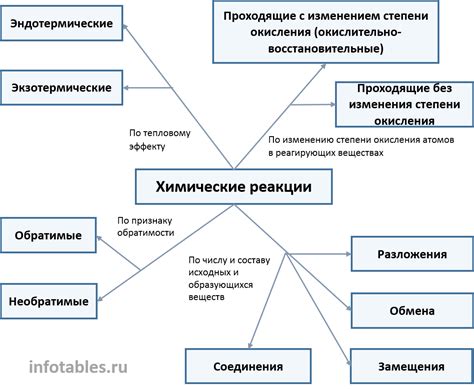
Разложение солей азотной кислоты легких металлов происходит в результате химической реакции между солью и водой, при которой образуются соответствующие оксиды металлов и азотная кислота. Эта реакция является эндотермической, то есть сопровождается поглощением тепла. Разложение солей азотной кислоты легких металлов особенно показательно при нагревании, когда происходит обильное выделение белого дыма и появление характерного запаха.
Процесс разложения солей азотной кислоты легких металлов по сути является диссоциацией соли на отдельные ионы металла и азотнокислотный радикал. Далее ионы металла реагируют с водой, образуя оксиды металла и выделяя молекулы азотной кислоты. В ходе разложения солей формируются также гидроксиды металла, основания или амфотерные соединения, в зависимости от химической природы металла и условий реакции.
Разложение солей азотной кислоты легких металлов имеет применение в различных технологических процессах. Например, в производстве газобетона, при разложении азотнокислых солей легких металлов образуется углекислый газ, который является причиной формирования пор на поверхности бетона. Также разложение солей применяется в химическом анализе для определения концентрации азотнокислых солей в растворах и отходах, а также в процессе получения осажденных соединений для дальнейшего использования в других технологических процессах.
Применение в промышленности

Разложение солей азотной кислоты легких металлов имеет широкое применение в различных отраслях промышленности. Комплексные азотные соединения, получаемые при этом процессе, обладают уникальными свойствами, которые находят применение в производстве различных материалов и химических соединений.
В металлургической промышленности разложение солей азотной кислоты легких металлов используется для получения металлических азидов. Эти вещества служат важным компонентом в процессах травления и активации поверхности металлических изделий перед нанесением покрытий.
Химическая промышленность использует разложение солей азотной кислоты легких металлов для получения азотистых кислот, которые затем применяются в производстве удобрений, пропеллентов и других химических соединений.
Энергетическая промышленность использует разложение солей азотной кислоты легких металлов для получения азотных оксидов, которые являются важными компонентами в процессах сжигания топлива для получения энергии.
И наконец, разложение солей азотной кислоты легких металлов находит применение в производстве взрывчатых веществ. Полученные при этом процессе азиды и нитраты служат основой для создания различных видов взрывчатых материалов, используемых в промышленности и военной сфере.
Производство удобрений и взрывчатых веществ

Производство удобрений и взрывчатых веществ является важным сектором химической промышленности. Одной из основных задач этого производства является производство удобрений для сельского хозяйства. Удобрения содержат необходимые для роста растений питательные вещества, такие как азот, фосфор и калий. Они играют ключевую роль в повышении урожайности и улучшении качества сельскохозяйственной продукции.
Для производства удобрений используют азотные соединения, в том числе соли азотной кислоты, получаемые из разложения аммиака или аммиака солей. После разложения солей азотной кислоты легких металлов, таких как натрий или калий, получаются нитраты, которые могут быть использованы в качестве удобрений. Нитраты представляют собой источник азота и представляют большую ценность для растений.
Производство взрывчатых веществ - еще одна важная отрасль, связанная с разложением солей азотной кислоты легких металлов. Взрывчатые вещества, такие как три нитроглицерин, тротил и другие, используются в промышленности, строительстве и армии. Они обладают высокой энергетической устойчивостью и могут использоваться для различных целей - от добычи полезных ископаемых до военных операций.
Вместе с тем, производство взрывчатых веществ требует особой осторожности и соблюдения строгих правил безопасности, так как они могут быть опасными и использоваться в неправильных целях. Поэтому, производство и использование взрывчатых веществ контролируется государственными органами и регламентируется специальными законодательствами.
Вопрос-ответ

Какие металлы могут разложить соль азотной кислоты?
Соль азотной кислоты может разложить легкие металлы, такие как натрий, калий, магний и алюминий.
Как происходит разложение солей азотной кислоты легких металлов?
При разложении солей азотной кислоты легких металлов происходит реакция, в результате которой образуется оксид металла, азотная диоксид и вода. Например, соль азотной кислоты натрия (NaNO3) разлагается по следующему уравнению: 2NaNO3 -> 2NaNO2 + O2 + H2O.
Какие применения имеет разложение солей азотной кислоты легких металлов?
Разложение солей азотной кислоты легких металлов имеет различные применения. Например, соль азотной кислоты натрия может использоваться для получения азотной кислоты, которая является важным реагентом во многих химических процессах. Также разложение солей азотной кислоты может использоваться для получения кислорода и использования его в промышленных процессах или медицине.
