Оксиды металлов - это химические соединения, состоящие из металлического элемента и кислорода. Они широко распространены как в природе, так и в технологических процессах. При нагревании оксиды металлов могут разлагаться на исходные элементы, что имеет большое значение в различных областях науки и промышленности. Разложение оксидов металлов может происходить по разным механизмам и под действием различных факторов.
Один из наиболее распространенных механизмов разложения оксидов металлов при нагревании - это термическое разложение. При нагревании оксиды металлов поглощают энергию в виде тепла и претерпевают химические превращения. В результате этого процесса металлические ионные соединения превращаются в металлы и кислород. Термическое разложение оксидов металлов широко используется в производстве металлов из их руд, получении кислорода и других важных химических соединений.
Еще одним механизмом разложения оксидов металлов при нагревании является восстановительное разложение. В этом случае оксиды металлов разлагаются под действием восстановительных реагентов, таких как углерод или водород. Этот механизм находит применение в различных процессах, например, при получении металлов из их оксидов с использованием различных видов реакций восстановления.
В целом, разложение оксидов металлов при нагревании является сложным и многогранным процессом, который имеет большое значение как с точки зрения фундаментальной науки, так и с точки зрения практического применения. Понимание механизмов разложения оксидов металлов позволяет разрабатывать новые методы синтеза материалов, улучшать технологические процессы и создавать новые продукты для различных сфер применения.
Оксиды металлов
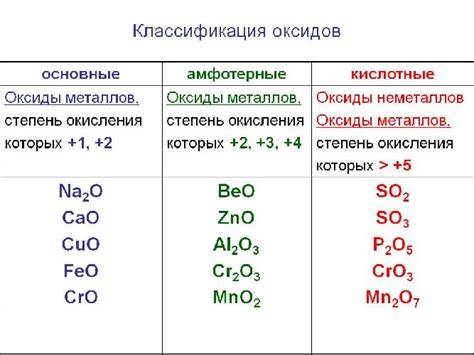
Оксиды металлов представляют собой соединения металлов с кислородом. Они образуются при взаимодействии металлических элементов с кислородом воздуха или в результате реакции металлов с кислородосодержащими веществами.
Оксиды металлов обладают различными физическими и химическими свойствами. Некоторые из них являются твердыми соединениями, такие как оксиды алюминия, железа, меди и цинка, а другие могут быть газообразными, например оксиды азота и углерода.
Оксиды металлов играют важную роль в промышленности и науке. Некоторые из них используются в качестве катализаторов, при производстве стекла, керамики и различных металлургических процессах. Некоторые оксиды металлов являются ключевыми компонентами в производстве красителей, подкрашивающих веществ и пигментов.
Кроме того, оксиды металлов широко используются в электронике и электротехнике. Они применяются в качестве полупроводниковых материалов, изоляторов и материалов для создания электродов, аккумуляторов и солнечных батарей. Оксиды металлов также широко используются в качестве красителей и защитных покрытий для поверхностей из различных материалов.
Физические и химические свойства оксидов металлов

Оксиды металлов - это химические соединения, состоящие из металла и кислорода. У них имеется широкий спектр физических и химических свойств.
Физические свойства оксидов металлов зависят от типа и структуры соединения. Некоторые оксиды металлов обладают высокой термической и электрической проводимостью, что делает их применимыми в электронной и электротехнике. Некоторые оксиды металлов имеют высокую твердость и прочность, что позволяет использовать их в строительстве и производстве материалов.
Химические свойства оксидов металлов определяют их реакционную способность. Оксиды металлов часто обладают кислотными свойствами и реагируют с водой, кислотами и основаниями. Некоторые оксиды металлов могут растворяться в воде и образовывать щелочные растворы. Другие оксиды металлов могут демонстрировать амфотерные свойства, то есть они могут реагировать и с кислотами, и с основаниями.
Оксиды металлов также обладают способностью каталитического действия. Они могут участвовать в различных реакциях, ускоряя их ход и повышая эффективность процессов. Это свойство оксидов металлов находит широкое применение в различных промышленных процессах, включая производство пластмасс, синтез катализаторов и очистку отходов.
Механизмы разложения оксидов металлов при нагревании

Разложение оксидов металлов при нагревании является важным процессом, изучение которого позволяет понять особенности поведения металлов и их оксидов при высоких температурах. Существует несколько механизмов разложения оксидов металлов, включающих физические и химические процессы.
Один из механизмов разложения оксидов металлов при нагревании - это диффузионное разложение. При этом процессе оксид металла распадается на металлический металл и кислородную фазу. Данный механизм основан на перемещении атомов кислорода через кристаллическую решетку оксида металла.
Важную роль в разложении оксидов металлов при нагревании играет также реакция среды. В некоторых случаях происходит реакция оксида металла с компонентами окружающей среды, такими как вода или водяной пар. Такая реакция приводит к образованию гидроксида металла и кислорода.
Еще одним механизмом разложения оксидов металлов является неконгругентное разложение. В процессе этого разложения оксид металла превращается в два или более продукта различной структуры и химического состава. Этот механизм обусловлен разделением атомов металла и кислорода, причем часть атомов кислорода может остаться в оксидной фазе, а часть мигрировать в окружающую фазу.
Термическое разложение оксидов металлов
Термическое разложение оксидов металлов - это процесс, при котором оксиды металлов распадаются на металл и кислород при нагревании. Этот процесс основан на изменении энергии связей в молекулах оксидов металлов и уделяет металлу и кислороду определенное количество энергии.
Механизм разложения оксидов металлов может быть различным в зависимости от химического состава и структуры соединения. Например, для некоторых оксидов металлов процесс разложения начинается с высвобождения кислорода, а затем металл остается в виде оксида, который также может разложиться при дальнейшем нагревании. Для других оксидов металлов разложение происходит непосредственно на металл и кислород.
Термическое разложение оксидов металлов имеет ряд применений. Одно из них - получение металлов из их оксидов. Например, алюминий может быть получен путем термического разложения его оксида (оксида алюминия). Этот процесс широко используется в промышленности для производства алюминия.
Кроме того, термическое разложение оксидов металлов может применяться для получения кислорода. Например, оксид магния может разложиться при нагревании, выделяя кислород и оставляя за собой металлический магний. Таким образом, термическое разложение оксидов металлов может быть важным процессом в химической промышленности для получения кислорода с высокой чистотой.
Каталитическое разложение оксидов металлов

Каталитическое разложение оксидов металлов является важным процессом в сфере химии и применяется во многих отраслях промышленности. Данный процесс основан на использовании катализаторов, которые ускоряют реакцию разложения оксида металла при нагревании.
Катализаторы могут быть различными веществами, включая металлы, сплавы или соединения. Они играют роль активных центров, на которых происходит химическая реакция разложения оксида металла. В процессе каталитического разложения оксидов металлов, катализатор обеспечивает энергетическую активацию молекул оксидов металлов, что позволяет им расщепиться на элементарные составляющие.
Каталитическое разложение оксидов металлов имеет широкий спектр применения. Оно используется в производстве полупроводников, катализаторов, электролизеров, а также в других отраслях промышленности. Например, в химической промышленности каталитическое разложение оксидов металлов может использоваться для получения высокочистых металлических порошков, которые затем используются в процессах синтеза материалов или при производстве электроники.
Каталитическое разложение оксидов металлов также является объектом исследования в области катализа и нанотехнологий. Ученые изучают различные аспекты этого процесса с целью улучшения его эффективности, скорости и селективности. Использование каталитического разложения оксидов металлов в новых технологиях может значительно повысить энергетическую эффективность процессов и снизить их вредные экологические последствия.
Применение разложения оксидов металлов при нагревании

Разложение оксидов металлов при нагревании является важным процессом, который находит свое применение в различных областях науки и промышленности. В основном, этот процесс применяется для получения металлов из их оксидов.
Одним из основных применений разложения оксидов металлов является получение чистых металлических материалов. Как правило, оксиды металлов в природе встречаются в больших количествах и обладают различными примесями. Путем нагревания и разложения оксидов можно получить чистые металлы, которые применяются в различных отраслях промышленности, таких как машиностроение, электроника, химическая промышленность и другие.
Кроме того, разложение оксидов металлов при нагревании также широко используется в процессе получения покрытий. Нагревание оксидов металлов позволяет получить тонкий слой металла на поверхности другого материала, такого как стекло, керамика или металл. Это позволяет улучшить характеристики материала, такие как прочность, устойчивость к коррозии и теплопроводность.
Также, разложение оксидов металлов при нагревании играет важную роль в процессе получения газообразных продуктов. Некоторые оксиды металлов при нагревании разлагаются, выделяя газы, которые могут быть использованы в различных отраслях промышленности. Например, оксид азота может быть получен из разложения оксида азота, а углекислый газ - из разложения оксида углерода.
---
Производство металлов

Производство металлов представляет собой сложный процесс, включающий ряд технологических операций. Одним из важных способов получения металлов является их разложение из оксидов при нагревании. Этот метод широко применяется в промышленности для получения различных металлов: железа, алюминия, свинца, меди и др.
Оксиды металлов разлагаются при нагревании с образованием свободного металла и выделением кислорода. Например, в случае разложения оксида железа (FeO) при нагревании, образуется металлическое железо и кислород. Это реакция окисления, в которой металл переходит из окисного состояния в металлическое состояние.
Процесс разложения оксидов металлов при нагревании применяется в различных отраслях промышленности. Например, в металлургии он используется для получения чистых металлов из руды. Также этот метод применяется в производстве стали, алюминия, цинка и других металлов.
Энергетика

Энергетика – это отрасль науки и экономики, изучающая производство, передачу, распределение и использование энергии. В контексте разложения оксидов металлов при нагревании, энергетика играет важную роль. Процесс нагревания оксидов металлов требует большого количества энергии.
С помощью разложения оксидов металлов можно получить энергию в виде тепла или электричества. Например, разложение воды на водород и кислород при нагревании оксида водорода (воды) может использоваться в водородных топливных элементах для производства электричества. Такое использование оксидов металлов является одним из перспективных направлений в области альтернативной энергетики.
Оксиды металлов при разложении могут образовывать также тепловую энергию, которую можно использовать в промышленности. Например, разложение оксида железа при нагревании позволяет получить высокую температуру, которая может использоваться для плавки металлов или производства электроэнергии.
Катализ

Катализ – это процесс, при котором добавление вещества, называемого катализатором, ускоряет химическую реакцию без его потребления. Катализаторы могут быть различного типа: гетерогенные (вещество в различных фазах) и гомогенные (вещество в одной фазе).
В процессе разложения оксидов металлов при нагревании катализаторы играют важную роль. Они способны ускорить реакцию разложения оксида, что позволяет получить требуемые продукты более быстро и эффективно. Катализаторы повышают скорость реакции, обеспечивая новые пути протекания процесса.
Применение катализаторов в разложении оксидов металлов при нагревании имеет широкие практические применения. Например, такие реакции могут быть использованы в производстве металлических порошков, которые широко применяются в медицине, электронике и других отраслях промышленности. Катализаторы также играют важную роль в экологии, помогая уменьшить выбросы вредных веществ в атмосферу при сжигании топлива и других процессах.
Электролиз

Электролиз – это процесс, при котором происходит разложение вещества под влиянием электрического тока. В ходе электролиза положительно заряженные ионы (катионы) притягиваются к отрицательно заряженному электроду (катоду), а отрицательно заряженные ионы (анионы) мигрируют к положительно заряженному электроду (аноду).
Применение электролиза включает широкий спектр областей. Например, электролиз применяется в производстве металлов, таких как алюминий и медь. В ходе этого процесса, электролитический раствор металлов подвергается электролизу, что приводит к осаждению металла на электроде. Это позволяет получать чистые металлические изделия с высокой степенью чистоты и качества.
Кроме того, электролиз находит применение в производстве химических соединений. Например, электролиз водного раствора соли, такой как NaCl, может привести к образованию хлора и натрия в виде газа и металлического осадка соответственно.
Электролиз также является важной техникой для проведения различных аналитических методов. Например, метод вольтамперометрии позволяет измерять электролитическую активность различных веществ, что находит применение в химическом анализе и научных исследованиях.
Вопрос-ответ

Какие металлы могут разлагаться при нагревании?
При нагревании разлагаются оксиды таких металлов, как железо, цинк, медь, свинец и другие.
Какие механизмы разложения оксидов металлов при нагревании существуют?
Разложение оксидов металлов при нагревании может происходить по различным механизмам, включая термическое разложение, редокс-реакции и растворение водах.
