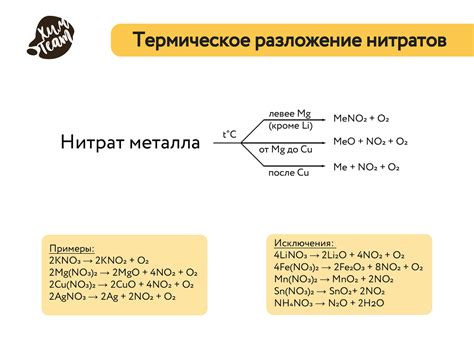
Реакция разложения нитратов является одной из важных химических реакций, связанных с активностью металлов. Нитраты – это соли с анионом NO3- и металлами. В ходе разложения нитратов происходит окисление аниона NO3- и восстановление металла.
Реакция разложения нитратов происходит в несколько этапов. Сначала нитраты нагреваются, что приводит к их декомпозиции с образованием двуокиси азота (NO2) и кислорода (O2). Далее двуокись азота диспропорционирует, то есть одна часть претерпевает окисление, а другая – восстановление. При этом образуется оксид азота(IV) (NO2) и оксид азота(II) (N2O).
Схема ряда активности металлов позволяет предсказать, какой металл будет активнее, а значит и какой участник реакции будет восстановлен. В ряду активности металлов, составленном по степени их активности, находятся наиболее активные металлы вверху, а наименее активные – внизу. Так, металлы, расположенные выше в ряду активности, могут вытеснить металлы, находящиеся ниже, из их солей, включая нитраты. Это означает, что более активные металлы способны восстанавливаться, а менее активные – окислять анион NO3-.
Схема ряда активности металлов

Схема ряда активности металлов представляет собой упорядоченный список металлов, расположенных по их активности в химических реакциях. Эта схема позволяет определить возможность реакции между различными металлами и кислотами, а также реакции восстановления и окисления.
Находясь в реакциях с кислотами, активные металлы образуют соли и выделяются водород, например, реакция цинка с серной кислотой:
Zn + H2SO4 → ZnSO4 + H2
Схема ряда активности металлов подразделяет металлы на две основные группы: активные металлы, которые реагируют с кислотами, и пассивные металлы, которые не реагируют с кислотами без дополнительных условий. Наиболее активные металлы, такие как литий или натрий, находятся в верхней части схемы, а наиболее пассивные металлы, такие как золото или платина, находятся в нижней части схемы.
Схема ряда активности металлов также позволяет определить возможность реакций восстановления и окисления. Например, если металл находится выше другого металла в схеме, то он способен восстановить этот металл из его ионной формы, например, реакция цинка с медным(II) купратом:
Zn + CuSO4 → ZnSO4 + Cu
Таким образом, схема ряда активности металлов является важным инструментом в химии, позволяющим предсказать возможность реакций между металлами и другими веществами на основе их относительной активности.
Разложение нитратов в химических реакциях
Разложение нитратов представляет собой химическую реакцию, в результате которой нитратные соединения превращаются в более простые вещества, такие как оксиды, азот и кислород.
Одна из самых распространенных реакций, связанных с разложением нитратов, это термическое разложение. При нагревании нитрата металла он распадается на соответствующий оксид и оксид азота. Например, нагревание нитрата свинца (II) приводит к образованию оксида свинца (II) и оксида азота (II):
2Pb(NO3)2 → 2PbO + 4NO2 + O2
Также важной реакцией, связанной с разложением нитратов, является аммонолиз. Это реакция, при которой нитрат аммония превращается в оксид азота и воду. Например:
2NH4NO3 → 2N2O + 4H2O + O2
Разложение нитратов играет важную роль в промышленных процессах, например, при производстве удобрений. А также оно широко используется в химических лабораториях для получения различных соединений.
Значение схемы ряда активности металлов

Схема ряда активности металлов – это удобное инструментарии для изучения и понимания химических реакций между металлами и их окисляющими агентами. Она отображает упорядоченный список металлов, расположенных в порядке убывания их активности в химических реакциях.
Зачастую, при проведении химических экспериментов или прогнозировании возможных реакций, схема ряда активности металлов является неотъемлемой частью химической лаборатории. С помощью нее можно определить, какой металл будет сильнее реагировать с окисляющим агентом, а какой – оставаться пассивным.
Схема ряда активности металлов также помогает понять законы электрохимических реакций. Металлы, находящиеся в верхней части ряда (например, литий, калий, натрий), реагируют гораздо более активно, образуя металлический ион и отделяя электроны. Это объясняет их высокую электродный потенциал и способность быть отличными восстановителями.
Важно отметить, что схема ряда активности металлов может быть использована не только для оценки активности металлов, но и для предсказания возможности прохождения реакций. Металлы, находящиеся выше других в ряду активности, будут замещать металлы, расположенные ниже их в ряду. Это основа реакций замещения металлов.
Процесс разложения нитратов
Разложение нитратов является важным процессом в химии, так как позволяет получать различные продукты. Как правило, разложение нитратов происходит при нагревании, под действием катализаторов или при контакте с другими веществами.
Одним из наиболее известных примеров разложения нитратов является разложение гидрохлоридов. При нагревании гидрохлорида металла, соединение распадается на хлорид металла и выделяется диоксид азота. Многие металлы, такие как свинец, медь и серебро, способны разлагать нитраты.
Разложение нитратов может происходить также при контакте с редуцирующими агентами. Например, при смешивании нитратов с пористым углем или органическими веществами происходит разложение нитратов с выделением газа. Этот процесс используется для получения азота в промышленных масштабах.
В химических реакциях разложения нитратов образуются различные продукты в зависимости от специфики реакции. Так, при разложении нитрата калия образуется кислород, при разложении нитрата кальция образуется оксид кальция и диоксид азота, а при разложении нитрата свинца образуется оксид свинца и диоксид азота.
Условия проведения химической реакции
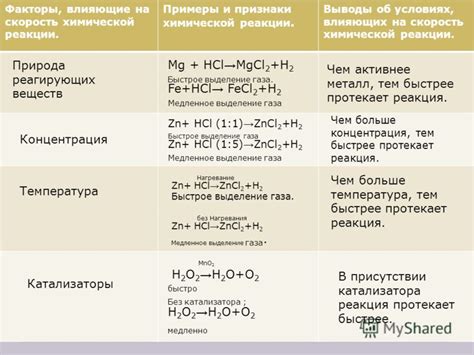
Химические реакции могут происходить при различных условиях, которые зависят от вида реакции и ее компонентов. В случае разложения нитратов металлов, особенно значительное значение имеют физические условия, такие как температура и давление.
Обычно разложение нитратов происходит при повышенных температурах. При нагревании нитрат вступает в реакцию с теплом и начинает распадаться на ионы металла, кислород и оксид азота. Температура, при которой происходит разложение нитратов, может быть поднята до нескольких сотен градусов. Однако, данная температура может зависеть от конкретного металла и его соединения.
На результат разложения нитратов также может влиять давление. Увеличение давления в реакционной системе может способствовать ускорению реакции и повышению выхода конечного продукта. Однако, чтобы контролировать давление в процессе разложения нитратов, требуется специальное оборудование и навыки работы с ним.
Итак, для проведения химической реакции разложения нитратов металлов необходимо создать определенные условия: повышенную температуру и, при необходимости, оптимальное давление. Точные значения этих условий могут различаться в зависимости от конкретного металла и его соединения, а также от технического оборудования, использованного для проведения реакции.
Влияние концентрации и температуры
Концентрация и температура - два фактора, которые влияют на ход химических реакций разложения нитратов металлов. Концентрация означает количество вещества в растворе, а температура - среднюю кинетическую энергию частиц вещества. Оба эти параметра могут влиять на скорость реакции и даже на ее возможность.
Увеличение концентрации нитратов металлов в реакционной среде может привести к увеличению скорости разложения. Это объясняется тем, что более высокая концентрация создает более благоприятные условия для столкновения молекул и, следовательно, активирует реакцию. Таким образом, более концентрированные растворы нитратов металлов могут разлагаться быстрее.
Температура также имеет важное значение при разложении нитратов металлов. Повышение температуры обычно увеличивает скорость реакции, поскольку это приводит к увеличению кинетической энергии молекул. Более высокая кинетическая энергия означает большую вероятность для успешных столкновений молекул и, как следствие, более быстрое разложение нитратов металлов.
Резюмируя, концентрация и температура являются важными факторами, определяющими ход и скорость разложения нитратов металлов. Увеличение концентрации и температуры может привести к более интенсивному разложению. Однако необходимо помнить, что слишком высокие значения этих параметров могут вызвать необратимые изменения в реакционной системе и привести к образованию нецелевых продуктов или разрушению вещества.
Практическое применение схемы ряда активности металлов

Схема ряда активности металлов является важным инструментом в химии и находит широкое практическое применение. Она позволяет определить степень активности различных металлов и предсказать их поведение в химических реакциях.
С использованием схемы ряда активности металлов можно определить, какой металл будет вытеснять другие металлы из их соединений при реакциях замещения. Это позволяет прогнозировать результаты реакций и выбирать наиболее подходящие металлы для различных технологических процессов.
В промышленности схема ряда активности металлов применяется, например, в процессе гальванизации. Зная степень активности металлов, можно выбрать подходящий металл для покрытия других металлических поверхностей, чтобы защитить их от коррозии. Также схема ряда активности металлов помогает в выборе электродов при проведении электролиза.
Схема ряда активности металлов также применяется в лаборатории. Она помогает определить, какие металлы реагируют с кислотами или другими реагентами и какие реакции между ними происходят. Эта информация полезна для анализа и исследований различных соединений и материалов.
Таким образом, схема ряда активности металлов имеет важное практическое значение и находит применение в различных отраслях науки и промышленности. Она помогает предсказать и объяснить химические реакции, выбирать подходящие металлы для различных процессов и проводить анализы и исследования в лаборатории.
Вопрос-ответ

Какова схема ряда активности металлов и зачем она нужна?
Схема ряда активности металлов представляет собой упорядоченный список металлов по их активности. Металлы располагаются в порядке возрастания их способности к вступлению в химические реакции. С помощью этой схемы можно предсказать, будут ли происходить реакции обмена между двумя металлами или между металлом и кислотой, а также определить, какие продукты образуются при этих реакциях.
Как происходит разложение нитратов металлов?
Разложение нитратов металлов происходит при нагревании. При этом нитраты распадаются на соответствующие оксиды и кислоты, а затем оксиды металлов дальше разлагаются на металлы и кислород. Например, нагревание нитрата свинца (II) приводит к образованию оксида свинца (II) и выделению кислорода.
Что происходит при реакции нитрата меди (II) с нитратом железа (III)?
При реакции нитрата меди (II) с нитратом железа (III) их ионы обмениваются местами, образуя нитрат меди (II) и нитрат железа (III). Это типичная реакция обмена металлами и их соединениями.
Какие металлы находятся выше по ряду активности, чем железо?
Металлы, которые находятся выше по ряду активности, чем железо, включают такие элементы, как калий, натрий, магний и алюминий. Это означает, что эти металлы более активны и сильнее реагируют с кислотами и другими веществами, чем железо.
