Оксиды металлов — это неорганические соединения, состоящие из металла и кислорода. Они широко распространены в природе и играют важную роль в различных процессах, включая химические реакции и промышленное производство. В зависимости от свойств и состава, оксиды металлов могут быть разделены на несколько групп.
Одна из основных групп оксидов металлов — это основные оксиды. Они образуются при сжигании металлов в присутствии кислорода и обладают щелочными свойствами. Примерами основных оксидов являются оксид натрия (Na2O) и оксид кальция (CaO). Они активно используются в производстве стекла, керамики и других материалов.
Кислотные оксиды — еще одна группа оксидов металлов. В отличие от основных оксидов, они образуются при сжигании металлов в присутствии кислорода с образованием кислотных растворов. Примерами кислотных оксидов являются оксид серы (SO2) и оксид азота (NO2). Они играют важную роль в химической промышленности, используясь в производстве удобрений и других химических соединений.
Одной из наиболее известных групп оксидов металлов являются амфотерные оксиды. Они обладают как кислотными, так и щелочными свойствами и могут реагировать как с кислотами, так и с щелочами. Примерами амфотерных оксидов являются оксид алюминия (Al2O3) и оксид цинка (ZnO). Они широко применяются в различных отраслях промышленности, включая производство керамики, электроники и катализаторов.
Изучение оксидов металлов имеет большое практическое значение и находит применение в различных областях, включая химическую промышленность, материаловедение и электронику. Понимание и управление свойствами оксидов металлов позволяет разрабатывать новые функциональные материалы и оптимизировать производственные процессы. Это делает оксиды металлов одним из ключевых объектов исследований в современной науке и промышленности.
Разнообразие оксидов металлов

Оксиды металлов представляют собой химические соединения, состоящие из металлического элемента и кислорода. В природе существуют множество различных оксидов металлов, каждый из которых обладает своими уникальными свойствами и применениями.
Одним из наиболее распространенных и известных оксидов металлов является оксид железа, среди которого наиболее популярным является оксид железа(III) или гематит. Этот оксид обладает красноватым цветом и широко используется в производстве стали и красок.
Однако оксиды металлов не ограничиваются только железом. Например, оксид алюминия (алюминиевая глина или глинозем) широко применяется в производстве керамики, стекла и алюминиевых сплавов.
Другим известным оксидом металла является оксид меди, применяемый в электротехнике и производстве аккумуляторов. Оксид кремния, также известный как кварц, является одним из основных составляющих песка и стекла.
Необходимо отметить, что оксиды металлов имеют различные степени окисления, что влияет на их химические и физические свойства. Например, оксиды металлов могут обладать полупроводниковыми свойствами или быть высокотемпературными катализаторами.
Изучение разнообразия оксидов металлов позволяет понять их роль в различных областях науки и техники. Благодаря своим уникальным свойствам оксиды металлов нашли широкое применение в промышленности, электронике, медицине и других отраслях человеческой деятельности.
Химический состав и структура

Оксиды металлов представляют собой химические соединения, состоящие из металла и кислорода. В составе оксидов металлов металл обязательно присутствует в ионной форме. Оксиды металлов могут иметь различные степени окисления металла и различную структуру.
Структура оксидов металлов может быть атомарной или кристаллической. В атомарной структуре каждый атом металла окружен кислородными атомами, образуя так называемый оксидный кластер. Атомы кислорода могут быть организованы по различным схемам: центрированной кубической решетке, гексагональной решетке и др.
Кристаллическая структура оксидов металлов определяется их симметрией и пространственным расположением атомов металла и кислорода. Оксиды металлов могут образовывать различные типы кристаллической решетки, такие как кубическая, гексагональная, тетрагональная и др.
В химическом составе оксидов металлов присутствует один или несколько ионов металла и ионы кислорода. Степень окисления металла может быть различной и зависит от конкретного оксида. Например, в оксиде железа (III) каждый атом железа имеет степень окисления +3, а в оксиде меди (I) каждый атом меди имеет степень окисления +1.
Физические и химические свойства
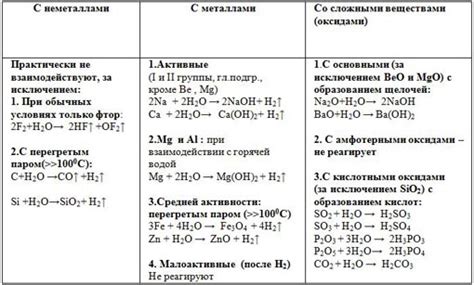
Физические свойства оксидов металлов. Оксиды металлов обладают различными физическими свойствами. В зависимости от состава и структуры, они могут быть твердыми, жидкими или газообразными веществами. Некоторые оксиды обладают высокой температурой плавления, например, оксид магния (MgO) имеет точку плавления около 2800 градусов Цельсия. Помимо этого, оксиды металлов могут быть как проводниками, так и непроводниками электричества.
Химические свойства оксидов металлов. Оксиды металлов обладают высокой реакционной способностью. Они вступают в реакции с водой, кислотами, щелочами и другими химическими веществами. Некоторые оксиды, например, оксид алюминия (Al2O3), обладают катализаторными свойствами, что позволяет использовать их в промышленности для ускорения реакций.
Реакция оксидов металлов с водой. Как правило, оксиды металлов реагируют с водой, образуя основные оксиды. Например, оксид натрия (Na2O) реагирует с водой, образуя щелочь натрия (NaOH). Реакция оксида цинка (ZnO) с водой приводит к образованию гидроксида цинка (Zn(OH)2). Реакция оксида железа (Fe2O3) с водой приводит к образованию гидроксида железа (Fe(OH)3).
Реакция оксидов металлов с кислотами. Оксиды металлов реагируют с кислотами, образуя соли и воду. Например, оксид кальция (CaO) реагирует с соляной кислотой (HCl) и образует хлорид кальция (CaCl2) и воду (H2O). Таким образом, оксид кальция является основанием. Реакция оксида алюминия (Al2O3) с серной кислотой (H2SO4) приводит к образованию сульфата алюминия (Al2(SO4)3) и воды (H2O).
Реакция оксидов металлов с щелочами. Оксиды металлов реагируют с щелочами, образуя соли и воду. Например, оксид калия (K2O) реагирует с гидроксидом натрия (NaOH) и образует карбонат калия (K2CO3) и воду (H2O). Таким образом, оксид калия является кислотным оксидом. Реакция оксида меди(I) (Cu2O) с гидроксидом натрия (NaOH) приводит к образованию сульфата меди(I) (Cu2CO3) и воды (H2O).
Вопрос-ответ

Какие виды оксидов металлов существуют?
Оксиды металлов делятся на множество видов в зависимости от химической формулы и свойств. Некоторые из них включают оксид железа (FeO), оксид алюминия (Al2O3), оксид кальция (CaO) и много других. Всего оксидов металлов насчитывается несколько сотен.
Какова основная особенность оксидов металлов?
Основная особенность оксидов металлов состоит в их способности взаимодействовать с кислородом. Они образуются при реакции металла с кислородом и представляют собой соединения металлов с кислородом.
Какие свойства у оксидов металлов?
Свойства оксидов металлов зависят от конкретного вида оксида, однако некоторые общие свойства включают высокую температуру плавления и кипения, низкую электропроводность, химическую инертность, способность к образованию кислотных или основных растворов в зависимости от оксида и другие.
Как оксиды металлов используются в промышленности?
Оксиды металлов имеют широкое применение в промышленности. Например, оксид железа используется в производстве стали, оксид алюминия применяется в производстве керамики и алюминиевых сплавов, оксид кальция используется в строительстве и др. Каждый вид оксида металла имеет свои неповторимые свойства и применения.
Являются ли оксиды металлов опасными для здоровья?
Некоторые оксиды металлов могут быть опасными для здоровья человека. Например, оксид меди (CuO) является токсичным и может вызывать различные проблемы с дыханием, если вдыхать его пары. Однако, большинство оксидов металлов не представляют опасности при обычных условиях использования.
