Равновесные электродные потенциалы металл-раствор - это важные характеристики взаимодействия металлов с растворами, которые определяют степень стабильности и реакционную способность системы. Данный параметр позволяет изучать электрохимические процессы, происходящие на поверхности металла в контакте с раствором. Он определяет возможность образования электрического тока между металлом и раствором, что в свою очередь имеет важное практическое значение в области электрохимии и гальваники.
Важными характеристиками равновесных электродных потенциалов являются их бесразмерность и отрицательность. Бесразмерность потенциалов обусловлена тем, что между двумя электродами всегда можно провести определенную разность потенциалов, которая может быть измерена. Отрицательность же связана с направлением движения электронов от металла к раствору, что определяет положительность электрического тока и потенциал обратной поляризации.
Применение равновесных электродных потенциалов металл-раствор включает такие области, как коррозия и защита металлов от коррозии, электроосаждение металлических покрытий, а также электроанализ и электрохимические методы исследования. Благодаря знанию равновесных потенциалов, можно предсказать химическую активность металла в конкретном растворе, определить скорость коррозии и разработать методы защиты от нее. Также эти параметры позволяют контролировать и регулировать процессы электроосаждения металла при создании покрытий или проведении анализа.
Основные характеристики равновесных электродных потенциалов металл-раствор:

1. Электродный потенциал - это мера энергии, которую электрон может получить или отдать при перемещении относительно электролита. Он определяет направление искомого электродного потенциала и зависит от конкретного металла и раствора.
2. Равновесные электродные потенциалы возникают, когда в системе установившиеся процессы электрохимической реакции протекают без каких-либо нетитальных токов. Они являются характеристиками данного электрода и зависят от его состояния и свойств.
3. Равновесные потенциалы определяются в стандартных условиях, то есть при 25 градусах Цельсия, давлении 1 атмосферы и стандартной концентрации ионов в растворе. Они могут быть положительными или отрицательными величинами. Сравнивая электродные потенциалы разных металлов, можно определить их активность и предсказать, как они взаимодействуют в электрохимических реакциях.
4. Научное значение равновесных электродных потенциалов металл-раствор состоит в их способности предсказывать происходящие реакции при взаимодействии различных материалов. Это позволяет эффективно применять электрохимические методы в различных областях, таких как электролиз, гальваническое покрытие, аккумуляторы и другие процессы, связанные с производством и использованием металлов.
5. Применение равновесных электродных потенциалов металл-раствор включает изучение коррозии металлов, определение их активности в химических процессах, создание электрохимических устройств и многое другое. Они также широко используются для разработки новых материалов с улучшенными свойствами и повышенной стойкостью к различным воздействиям.
Равновесные потенциалы:
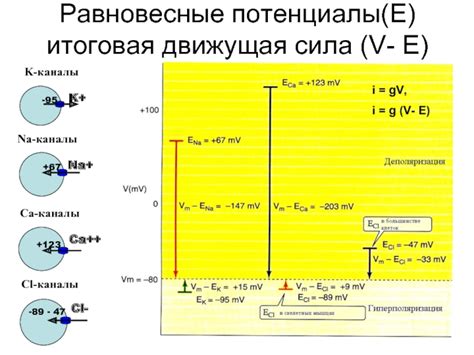
Равновесные потенциалы представляют собой электродные потенциалы, которые устанавливаются на границе раздела металла и раствора при достижении электрохимического равновесия. Они обусловлены процессами окисления и восстановления, которые происходят между металлом и раствором. Равновесные потенциалы являются важным показателем активности металла в растворе и могут быть определены экспериментально или рассчитаны с использованием специальных теоретических моделей.
Равновесные потенциалы имеют большое значение для различных областей науки и техники. Они используются в электрохимических исследованиях, в химическом анализе, в производстве электрохимических источников энергии, в коррозионных исследованиях и др. Они также могут быть использованы для определения стандартного электродного потенциала металла, что является важной характеристикой его химической активности и стойкости к коррозии.
Определение равновесного электродного потенциала металла в растворе может быть выполнено с использованием различных методов, таких как измерение электродного потенциала с использованием референтного электрода или измерение коррозионного тока при различных потенциалах. Кроме того, равновесные потенциалы могут быть рассчитаны с использованием уравнения Нернста, которое описывает зависимость электродного потенциала от концентрации реагентов и температуры.
- Равновесные потенциалы могут быть использованы для оценки термодинамических параметров реакций окисления и восстановления металлов в растворе.
- Изменение равновесных потенциалов металлов может свидетельствовать о наличии химических реакций, происходящих на границе металл-раствор.
Металл-раствор:
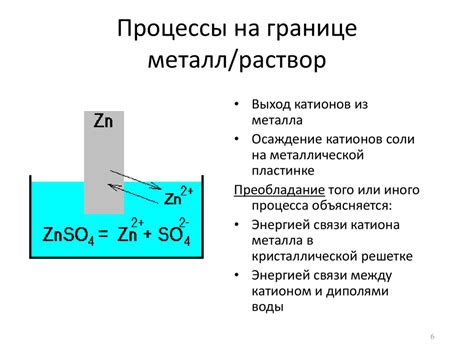
Металл-раствор представляет собой химическую систему, содержащую растворенные и нерастворимые металлические компоненты. Основные характеристики металл-раствора определяются составом и концентрацией растворенных металлов, а также условиями проведения процесса растворения.
Одной из основных характеристик металл-растворов является равновесный электродный потенциал. Этот параметр определяет способность металл-раствора взаимодействовать с другими материалами или электродами и может использоваться для оценки коррозионной стойкости материала или расчета электрохимических процессов.
Металл-растворы находят широкое применение в различных областях, включая металлургию, электрохимию, строительство, электронику и многие другие. Они используются для получения и обработки металлических материалов, создания защитных покрытий, электрохимического анализа и других технологических процессов.
С помощью металл-растворов можно осуществлять электрохимические процессы, такие как электролиз, гальваническое осаждение и электрохимическая коррозия. Изучение равновесных электродных потенциалов металл-растворов позволяет понять основные принципы этих процессов и разработать эффективные методы их контроля и регулирования.
Влияние физико-химических параметров:

При исследовании равновесных электродных потенциалов металл-раствор важно учитывать различные физико-химические параметры, которые могут оказывать значительное влияние на эти потенциалы. Одним из таких параметров является концентрация раствора.
Увеличение концентрации раствора может привести к изменению равновесных электродных потенциалов металл-раствор. Высокая концентрация раствора может способствовать образованию активного слоя на поверхности металла, что может изменить потенциал электрода.
Температура также является важным физико-химическим параметром, который влияет на равновесные электродные потенциалы. Повышение температуры может увеличить скорость химических реакций на поверхности электрода и изменить потенциалы анодных и катодных реакций.
Помимо этого, растворность газов и наличие электролитов также влияют на равновесные электродные потенциалы металл-раствор. Растворность газов может изменяться в зависимости от давления и температуры, что может влиять на концентрацию газов на поверхности металла и изменять потенциалы электродов.
Таким образом, физико-химические параметры, такие как концентрация раствора, температура, растворность газов и наличие электролитов, играют важную роль в определении равновесных электродных потенциалов металл-раствор.
Процессы окисления и восстановления:

Окисление - это процесс, при котором вещество теряет электроны или добавляет кислород. В результате окисления образуются оксиды. Окисление может происходить в реакциях с воздухом, кислородом или другими окислителями.
Восстановление - это процесс, при котором вещество получает электроны или теряет кислород. В результате восстановления образуются вещества с более низкой степенью окисления. Восстановление может происходить в реакциях с водородом или другими восстановителями.
Процессы окисления и восстановления являются важнейшими в химии и имеют широкое применение. Например, процессы окисления и восстановления играют важную роль в электрохимических реакциях, таких как гальванические элементы и электролиз. В электрохимических реакциях происходит перенос электронов между оксидационно-восстановительными системами, что позволяет получать электрическую энергию.
Кроме того, процессы окисления и восстановления широко применяются в различных промышленных процессах. Например, в процессе гальванизации металлы покрывают слоем другого металла, используя электрохимические реакции окисления и восстановления. Это позволяет улучшить защитные свойства материала и придать ему определенные свойства, такие как антикоррозионность или декоративность.
Таким образом, процессы окисления и восстановления являются важными фундаментальными явлениями в химии и находят широкое применение в различных областях человеческой деятельности.
Применение равновесных электродных потенциалов:

1. Определение основных характеристик металлических материалов: Равновесные электродные потенциалы металл-раствор являются важным инструментом для определения основных характеристик металлических материалов, таких как их активность, коррозионную стойкость и потенциалы пассивации. Путем измерения равновесных электродных потенциалов металлов в различных растворах можно получить информацию о их химической активности и способности к реакциям с окружающей средой.
2. Определение условий равновесия в системе металл-раствор: Зная равновесный электродный потенциал металла и его концентрацию в растворе, можно определить условия равновесия в системе металл-раствор. Это позволяет определить, будет ли металл растворяться в растворе или будет покрываться пассивной пленкой. Например, если равновесный электродный потенциал металла меньше, чем потенциал покрытия пленкой, то металл будет растворяться в растворе.
3. Контроль коррозионных процессов: Равновесные электродные потенциалы металл-раствор устанавливаются при наличии устойчивого равновесия между металлом и раствором. Измерение этих потенциалов помогает контролировать и предотвращать коррозионные процессы, так как они позволяют определить возможность растворения металла и образования пассивной пленки на его поверхности.
4. Применение в электрохимическом анализе: Равновесные электродные потенциалы металл-раствор широко используются в электрохимическом анализе для определения концентрации и других характеристик различных веществ. Изменение потенциала при измерении позволяет определить концентрацию ионов в растворе. Это применяется, например, в анализе воды и определении содержания металлов в растворах.
5. Исследование электрохимических процессов: Измерение равновесных электродных потенциалов металл-раствор играет важную роль в исследовании электрохимических процессов. Путем измерения потенциалов и изменения их значений можно определить кинетику и характеристики различных электрохимических реакций и процессов, таких как окислительно-восстановительные реакции, гальванические элементы и электролиз.
Контроль равновесных электродных потенциалов:

Контроль равновесных электродных потенциалов металл-раствор является важным этапом в анализе и исследовании химических процессов. Этот контроль позволяет определить электродные потенциалы, при которых происходит равновесие между металлом и его раствором.
Одним из способов контроля равновесных электродных потенциалов является использование специальных электродов, таких как стандартные водородные электроды. Эти электроды обеспечивают постоянное значение электродного потенциала и используются в качестве эталонов для определения потенциалов других электродов.
Другой способ контроля равновесных электродных потенциалов - это использование электролитических ячеек. Эти ячейки состоят из двух электродов, погруженных в растворы, и позволяют измерить потенциалы электродов при различных условиях.
Контроль равновесных электродных потенциалов металл-раствор является необходимым для определения активности металлов в растворах и для изучения процессов окисления и восстановления. Этот контроль также имеет широкое применение в области электрохимии и гальваники.
Перспективы исследований:

Равновесные электродные потенциалы металл-раствор представляют значительный интерес для исследований в различных областях науки и техники. Например, в области коррозионной стойкости материалов, исследования равновесных электродных потенциалов позволяют выявить наиболее устойчивые сплавы и покрытия для защиты от коррозии.
Другой перспективной областью исследований является электрохимическая и катодная защита. Равновесные электродные потенциалы металл-раствор позволяют оценить эффективность различных методов защиты от коррозии и найти наилучшее сочетание материалов для применения в конкретных условиях эксплуатации.
Исследование равновесных электродных потенциалов также имеет важное значение в области электрохимического синтеза материалов. Определение потенциалов электродов и их влияние на электрохимический процесс позволяет оптимизировать условия синтеза и получить материалы с желаемыми свойствами.
Биоэлектрохимические исследования, связанные с электрохимическими процессами в биологических системах, также являются перспективным направлением. Изучение равновесных электродных потенциалов металл-раствор в биологических средах позволяет понять их взаимодействие и разработать новые методы и препараты для диагностики и лечения различных заболеваний.
Вопрос-ответ

Какие основные характеристики равновесных электродных потенциалов металл-раствор?
Равновесные электродные потенциалы металл-раствор - это показатели, характеризующие способность металла вступать в реакции с раствором. Они позволяют определить, насколько металл стабилен в данном растворе. Основными характеристиками равновесных электродных потенциалов являются электродный потенциал и потенциальный барьер.
Для чего используются равновесные электродные потенциалы металл-раствор?
Равновесные электродные потенциалы металл-раствор находят применение в различных областях, таких как химическая промышленность, электрохимия и биология. Они используются для оценки стабильности металла в контакте с определенным раствором, определения электродного потенциала металла и контроля коррозии. Также они позволяют проводить анализ состояния металла и предсказывать его поведение в различных условиях.
