Растворимость сульфатов щелочноземельных металлов – одна из важнейших характеристик этих соединений, которая имеет особое значение в химической промышленности и научных исследованиях. Щелочноземельные металлы – это группа химических элементов, которые включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr) и барий (Ba). Сульфаты данных металлов обладают различной степенью растворимости в воде и других растворителях. Понимание особенностей растворимости сульфатов щелочноземельных металлов является важной предпосылкой для их применения в различных отраслях науки и техники.
Одной из основных причин, по которой изучают растворимость сульфатов щелочноземельных металлов, является их применение в процессах обогащения руд. Вследствие своей различной растворимости сульфаты этих металлов используются для выделения и извлечения полезных компонентов из природных источников. Например, барийсульфат (BaSO4) широко применяется в медицине и рентгенологии в качестве контрастного вещества для создания изображений внутренних органов и систем организма. Кальцийсульфат (CaSO4) используется в строительстве, медицине, а также в процессе производства гипсовых изделий и прочих строительных материалов.
Интересный факт: Магнийсульфат (MgSO4) или эпсомсоль, наряду с медицинским использованием, также применяется в сельском хозяйстве в качестве удобрения для подкормки растений.
Однако, растворимость сульфатов щелочноземельных металлов имеет свои особенности. Например, сульфаты бария (BaSO4) и стронция (SrSO4) плохо растворимы в воде и имеют низкую степень растворимости. Это явление обусловлено образованием малорастворимых оснований – гидратированных ионообменных комплексов, которые способны образовывать коллоидные растворы или осаждаться в виде нерастворимого осадка. Эта особенность сульфатов бария и стронция нашла применение в аналитической химии, в частности, для выявления присутствия этих элементов в образцах различной природы.
Свойства и состав
Сульфаты щелочноземельных металлов представляют собой соединения этих металлов с ионами сульфата. Они обладают растворимостью в воде, которая зависит от ряда факторов, таких как температура, концентрация и степень ионизации.
Растворимость сульфатов щелочноземельных металлов увеличивается с повышением температуры. Например, сульфат кальция (CaSO4) имеет низкую растворимость при комнатной температуре, но его растворимость значительно увеличивается при нагревании.
Состав сульфатов щелочноземельных металлов может быть различным. Например, сульфат магния (MgSO4) содержит ионы магния (Mg2+) и ионы сульфата (SO42-). Сульфат бария (BaSO4) состоит из ионов бария (Ba2+) и ионов сульфата.
Сульфаты щелочноземельных металлов находят широкое применение в различных областях, включая медицину, производство химических соединений, строительство и сельское хозяйство. Например, сульфат магния используется в качестве лекарственного препарата и в производстве удобрений. Сульфат кальция используется в строительстве и для улучшения почвы.
Влияние температуры на растворимость
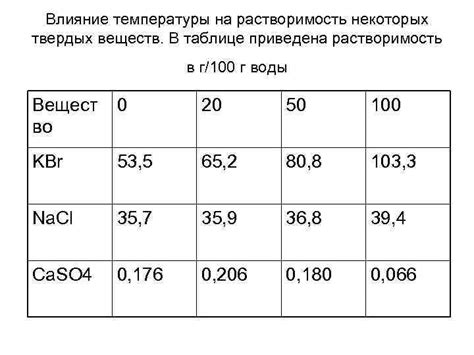
Температура является важным фактором, влияющим на растворимость сульфатов щелочноземельных металлов. Общим правилом является то, что с ростом температуры растворимость сульфатов обычно увеличивается. Это связано с тем, что при повышении температуры молекулы вещества обладают большей энергией, что способствует разрушению связей и увеличению скорости движения частиц. Это позволяет растворителю лучше проникать в решетку кристаллической структуры и освобождать ионы металла и сульфат.
В то же время есть исключения из этого правила. Например, растворимость сульфата магния кристаллической воды (MgSO4 · 7H2O) при повышении температуры уменьшается. При нагревании происходит дегидратация кристаллической воды, и часть воды выходит из решетки соединения. Таким образом, растворимость сульфата магния снижается вместе с увеличением температуры.
Влияние температуры на растворимость сульфатов щелочноземельных металлов имеет практическое применение. Например, это знание может быть использовано при разработке процессов очистки и извлечения металлов из руд или отходов промышленности. Изменение температуры может привести к образованию осадков или изменению концентрации растворов, что может быть использовано для разделения и получения желаемых соединений.
Роль ионного равновесия
Ионное равновесие играет важную роль в процессе растворения сульфатов щелочноземельных металлов. В растворе сульфаты щелочноземельных металлов диссоциируют на ионы металла и сульфат-ионы. Это происходит благодаря взаимодействию водных молекул с ионами вещества. Ионное равновесие между сульфат-ионами и ионами металла поддерживается в процессе растворения.
Ионное равновесие является важным фактором, определяющим растворимость сульфатов щелочноземельных металлов. Оно обуславливает стабильность ионов в растворе и влияет на вероятность образования осадков или выпадения веществ из раствора. Изменение условий растворения, таких как температура, pH или концентрация раствора, может привести к смещению ионного равновесия и, как следствие, к изменению растворимости сульфатов щелочноземельных металлов.
Ионное равновесие играет важную роль не только в химических процессах, но и в различных приложениях сульфатов щелочноземельных металлов. Например, знание ионного равновесия позволяет контролировать растворимость сульфатов и использовать их в процессах очистки воды или при синтезе новых материалов. Также, изменение ионного равновесия может быть использовано для получения осадков или обратного выпадения веществ из раствора, что позволяет проводить различные процессы разделения и очистки веществ.
Таким образом, понимание ионного равновесия является ключевым для понимания растворимости сульфатов щелочноземельных металлов и их применения в различных областях науки и техники.
Влияние pH на растворимость
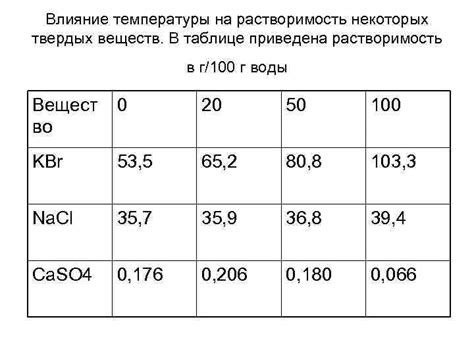
Растворимость сульфатов щелочноземельных металлов является важным аспектом их химического поведения. Один из факторов, влияющих на растворимость этих соединений, - это pH раствора. pH определяет степень кислотности или щелочности раствора и может иметь значительное влияние на химические реакции, которые происходят с сульфатами щелочноземельных металлов.
Общим правилом является то, что щелочноземельные сульфаты обладают большей растворимостью в щелочных растворах, а меньшей растворимостью в кислых средах. Это связано с ионизацией сульфатов и их взаимодействием с ионами водорода в растворах с разным pH.
Например, сульфаты магния и кальция образуют осадки в присутствии кислых растворов. В кислой среде ионы водорода реагируют с ионами магния и кальция, сохраняющими их в осадочной форме.
Однако, если раствор становится щелочным, ионы гидроксида начинают реагировать с ионами магния и кальция, образуя более растворимые соединения. В результате сульфаты магния и кальция становятся более растворимыми в щелочных растворах.
Исходя из этого, можно сделать вывод, что растворимость сульфатов щелочноземельных металлов зависит от pH раствора. Это важно учитывать при проектировании и контроле процессов, где используются эти соединения, а также при разработке и оптимизации различных химических формул.
Применение в промышленности

Сульфаты щелочноземельных металлов имеют широкое применение в различных отраслях промышленности. Например, сульфат магния (MgSO4) используется в производстве удобрений, стекла, бумаги, красителей, лекарственных препаратов и косметических средств. Он также применяется в процессах очистки воды и удаления тяжелых металлов из промышленных стоков.
Сульфат кальция (CaSO4) нашел свое применение в строительной отрасли. Он используется в качестве ингредиента в производстве строительных материалов, таких как гипсовые плиты и штукатурка. Сульфат кальция также применяется в процессах очистки и обеззараживания сточных вод, а также в производстве пищевых добавок.
Сульфат бария (BaSO4) используется в медицине для проведения рентгенологических исследований и создания контрастных веществ. Бариевые сульфаты также применяются в производстве красок, пигментов, стекол и керамики.
Помимо этого, сульфаты щелочноземельных металлов используются в промышленности для очистки газов от вредных примесей, охлаждения радиаторов, производства электрической энергии и многих других процессов.
Значение в медицине

Сульфаты щелочноземельных металлов, такие как сульфат магния и сульфат кальция, имеют важное значение в медицине. Сульфат магния, также известный как эпсомская соль, широко используется для лечения различных заболеваний и состояний.
Сульфат магния применяется в качестве спазмолитика для устранения мышечных спазмов и болей, также он может быть использован для лечения предродовых и послеродовых судорог у беременных женщин. Благодаря своим особенностям, сульфат магния может снизить агрессивность и чувствительность рефлексов, что важно для успокоения и снятия боли у пациентов с определенными состояниями.
Сульфат кальция также имеет медицинское применение. Он используется для компенсации дефицита кальция в организме, что особенно важно для пациентов с остеопорозом и другими заболеваниями, связанными с недостатком кальция. Кроме того, сульфат кальция применяется для лечения аллергических реакций, так как он может уменьшить выделение гистамина и других веществ, вызывающих аллергические симптомы.
Взаимодействие с другими веществами

Сульфаты щелочноземельных металлов могут взаимодействовать с различными веществами, образуя новые соединения или изменяя свои свойства.
Наиболее распространенным взаимодействием сульфатов щелочноземельных металлов является реакция с кислотами. При этом образуются новые соединения - соли и вода. Например, сульфат кальция реагирует с соляной кислотой, образуя хлорид кальция и серную кислоту.
Также сульфаты могут взаимодействовать с основаниями, приводя к образованию новых соединений - гидроксидов щелочноземельных металлов. Например, сульфат магния реагирует с гидроксидом натрия, образуя гидроксид магния и сульфат натрия.
Некоторые сульфаты обладают свойством образовывать сложные соединения, например, комплексы с некоторыми металлами. Это свойство может использоваться в аналитической химии для определения содержания металлов в пробах.
Известна также реакция сульфатов щелочноземельных металлов с растворимыми солями некоторых тяжелых металлов. В результате образуются нерастворимые осадки, которые могут использоваться для удаления тяжелых металлов из водных растворов или очистки сточных вод.
Вопрос-ответ

Какие сульфаты щелочноземельных металлов растворимы в воде?
Сульфаты щелочноземельных металлов, таких как магний, кальций, стронций и барий, обладают различной степенью растворимости в воде. Магниевый сульфат и кальциевый сульфат хорошо растворимы в воде, в то время как сульфаты стронция и бария плохо растворимы.
Как растворимость сульфатов щелочноземельных металлов зависит от температуры?
Растворимость сульфатов щелочноземельных металлов зависит от температуры. Обычно, с повышением температуры, растворимость увеличивается. Например, растворимость магниевого сульфата и кальциевого сульфата в воде увеличивается с повышением температуры, в то время как растворимость стронциевого и бариевого сульфатов остается практически неизменной.
Какие особенности имеет растворимость бариевого сульфата?
Бариевый сульфат является одним из наименее растворимых сульфатов щелочноземельных металлов. Он практически нерастворим в воде, при комнатной температуре его растворимость составляет около 2 миллиграмм на литр воды. Бариевый сульфат обладает высокой плотностью и используется в различных отраслях промышленности, например, в производстве светофильтров и лакокрасочных материалов.
Каково практическое применение растворимых сульфатов щелочноземельных металлов?
Растворимые сульфаты щелочноземельных металлов имеют широкое применение в различных областях. Например, кальциевый сульфат используется в медицине для лечения различных заболеваний, а магниевый сульфат используется в сельском хозяйстве в качестве удобрения. Кроме того, эти сульфаты могут использоваться в производстве бумаги, в текстильной промышленности и в качестве добавок в пищу.
