Карбонаты щелочных металлов являются одними из наиболее распространенных неорганических соединений. Они обладают рядом уникальных физико-химических свойств, которые влияют на их растворимость в различных средах.
Основное свойство карбонатов щелочных металлов - их способность образовывать растворы с щелочной реакцией. Это связано с тем, что карбонатные ионы образуются в результате реакции между гидроксидами металлов и угольной кислотой. Такие реакции обычно сопровождаются выделением углекислого газа (СО2) и образованием осадка в виде нерастворимого карбоната металла.
Важно отметить, что растворимость карбонатов щелочных металлов зависит от pH среды. В щелочной среде карбонаты металлов обычно растворимы, так как образование гидроксида металла позволяет поддерживать растворимость карбоната. Однако в кислых условиях растворимость карбонатов снижается, так как преобладает окислительное воздействие на карбонатные ионы и образуется угольная кислота, которая теряет связь с гидроксидами щелочных металлов.
Влияние растворимости карбонатов щелочных металлов на химические реакции
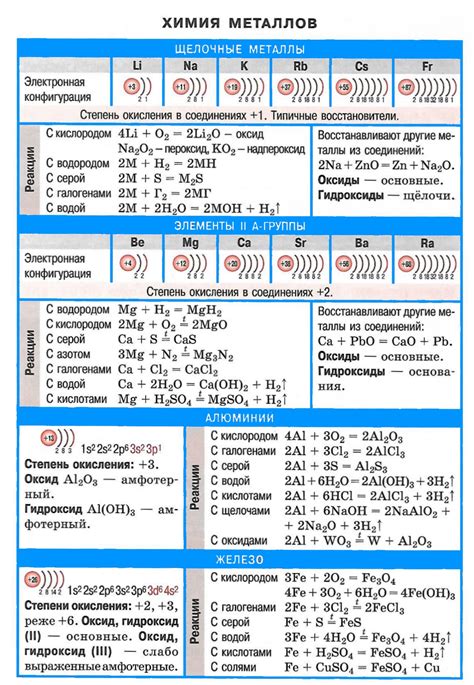
Растворимость карбонатов щелочных металлов, таких как натрий, калий и литий, играет важную роль в различных химических реакциях.
Во-первых, растворимость карбонатов щелочных металлов определяет их способность взаимодействовать с другими веществами. Несмотря на то что карбонаты щелочных металлов обладают высокой растворимостью в воде, они могут образовывать нерастворимые осадки при взаимодействии с определенными кислотами или солями. Это явление можно использовать в химическом анализе для выделения специфических ионов или определения концентрации веществ в растворе.
Во-вторых, растворимость карбонатов щелочных металлов влияет на pH растворов, в которых они находятся. Карбонаты щелочных металлов реагируют с водой, образуя гидроксиды и углекислый газ. Если концентрация углекислого газа достаточно высока, раствор становится кислотным. Это может быть полезным при регулировании pH растворов или при выполнении химических реакций, где pH играет важную роль.
Наконец, растворимость карбонатов щелочных металлов может влиять на скорость химических реакций. Если карбонаты щелочных металлов находятся в больших количествах в реакционной смеси, они могут замедлить реакцию или вовсе препятствовать ее протеканию. В таких случаях может потребоваться изменение условий реакции, таких как температура или концентрация реагентов, чтобы достичь желаемого результата.
Таким образом, растворимость карбонатов щелочных металлов имеет значительное влияние на химические реакции. Она определяет способность этих веществ взаимодействовать с другими веществами, влияет на pH растворов и может оказывать влияние на скорость реакций. Понимание этих особенностей позволяет эффективно использовать карбонаты щелочных металлов в различных химических процессах и получать желаемые результаты.
Растворимость карбонатов щелочных металлов и ее значение
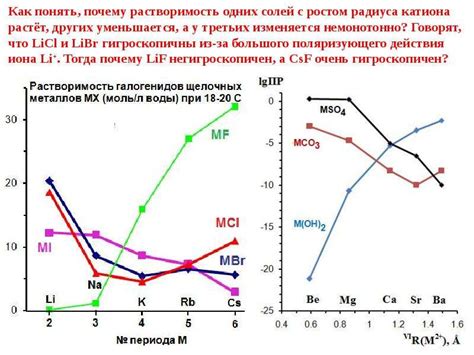
Растворимость карбонатов щелочных металлов - важная характеристика, определяющая их поведение в химических реакциях и их использование в различных областях науки и промышленности. Растворимость карбонатов показывает, насколько легко эти соединения растворяются в воде или других растворителях, и это связано с их кристаллической структурой и химическими свойствами.
Значение растворимости карбонатов щелочных металлов состоит в том, что они являются исходными соединениями для получения щелочных металлов и их соединений. Карбонаты щелочных металлов широко применяются в производстве стекла, щелочных батарей, моющих средств и других химических продуктов. Растворимость карбонатов определяет эффективность и качество этих процессов и продуктов.
Растворимость карбонатов щелочных металлов также играет важную роль в окружающей среде. Она влияет на процессы образования и растворения карстовых явлений, формирования карстовых пещер и провалов. Также растворимость карбонатов щелочных металлов влияет на содержание этих элементов в почвах и водах, что имеет значение для сельского хозяйства, экологии и охраны природных ресурсов.
Исследование растворимости карбонатов щелочных металлов является важной научной задачей, направленной на понимание физико-химических свойств этих соединений и развитие новых материалов и технологий. Определение растворимости карбонатов щелочных металлов проводится с использованием различных методов, таких как гравиметрический, количественный и спектрофотометрический анализ, что позволяет получить точные данные и обеспечить последующую их интерпретацию и использование.
Физико-химические особенности растворимости карбонатов
Растворимость карбонатов щелочных металлов зависит от их физико-химических особенностей. Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, образуют карбонаты, которые обладают определенной растворимостью в воде.
Одним из ключевых факторов, влияющих на растворимость карбонатов щелочных металлов, является полярность растворителя. Вода, будучи полярным растворителем, взаимодействует с ионами карбонатов, образуя гидратные оболочки вокруг ионов. Это облегчает растворение карбонатов щелочных металлов в воде.
Карбонаты щелочных металлов также обладают свойством образовывать соли с другими ионами. Например, карбонат натрия (Na2CO3) образует соли с различными кислотами, такими как сульфатная (Na2SO4), хлоридная (NaCl) и нитратная (NaNO3). Это свойство карбонатов щелочных металлов позволяет им быть вовлеченными в многочисленные химические реакции.
Кроме того, растворимость карбонатов щелочных металлов может зависеть от условий окружающей среды, таких как температура. В общем случае, с увеличением температуры растворимости ионов карбонатов увеличивается. Это связано с тем, что повышение температуры приводит к увеличению скорости движения молекул и усилению их энергии, что способствует разрыву связей между ионными частицами и облегчает растворение карбонатов.
Карбонаты щелочных металлов и их влияние на кислотно-щелочные реакции
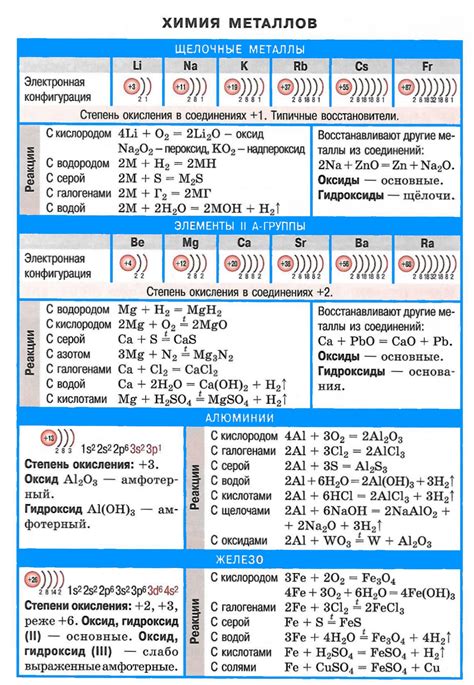
Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и др., образуют стабильные карбонаты при взаимодействии с углекислым газом. Водные растворы карбонатов щелочных металлов обладают щелочными свойствами и проводят электрический ток, что связано с формированием гидроксидных и карбонатных ионов в растворе.
Карбонаты щелочных металлов играют важную роль в кислотно-щелочных реакциях. Они могут реагировать с кислотами, образуя соли и выделяя углекислый газ. Например, реакция между карбонатом натрия (Na2CO3) и соляной кислотой (HCl) приводит к образованию соли - хлорида натрия (NaCl) и выделению углекислого газа (CO2):
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
Карбонаты щелочных металлов также могут реагировать с щелочными оксидами, образуя соли и воду. Например, реакция между карбонатом натрия (Na2CO3) и гидроксидом калия (KOH) приводит к образованию соли - карбоната калия (K2CO3) и воды (H2O):
Na2CO3 + 2KOH → K2CO3 + NaOH + H2O
Таким образом, карбонаты щелочных металлов не только растворяются в воде и проявляют щелочные свойства, но и активно участвуют в реакциях с кислотами и щелочными оксидами, играя важную роль в кислотно-щелочных реакциях.
Влияние растворимости карбонатов на образование осадков и нерастворимых соединений

Растворимость карбонатов щелочных металлов играет важную роль в химических реакциях, так как определяет возможность образования осадков и нерастворимых соединений. Карбонаты щелочных металлов, таких как натрий, калий и гидроксиды, широко применяются в различных отраслях промышленности и исследованиях.
Растворимость карбонатов зависит от многих факторов, таких как pH раствора, температура и концентрация реагентов. Наиболее распространенные карбонаты щелочных металлов, такие как натрий и калий, обладают высокой растворимостью в воде и образуют прозрачные растворы. Однако, при низкой температуре и повышении концентрации карбонатов, может произойти образование осадков и нерастворимых соединений.
Образование осадков и нерастворимых соединений имеет большое значение в различных процессах, таких как химические реакции, очистка воды, производство минеральных удобрений и других технологиях. Нерастворимые карбонаты могут осаждаться в системе и вызывать проблемы, такие как забивание трубопроводов или оборудования, снижение эффективности процессов и даже повреждение оборудования.
Понимание и контроль растворимости карбонатов щелочных металлов позволяет эффективно управлять процессами образования осадков и нерастворимых соединений. Это требует постоянного мониторинга и регулирования реакционных условий, таких как pH, температура и концентрация реагентов. Также возможно использование ингибиторов или других химических добавок для предотвращения образования осадков и нерастворимых соединений.
Применение растворимости карбонатов щелочных металлов в производстве и научных исследованиях

Растворимость карбонатов щелочных металлов играет важную роль в различных отраслях производства и научных исследованиях. Эти карбонаты, такие как карбонат натрия (Na2CO3), карбонат калия (K2CO3) и другие, широко применяются в химической промышленности и лабораторных исследованиях.
В производстве на основе растворимости карбонатов щелочных металлов используются для производства стекла, мыла, моющих средств, щелочных батарей, электролитов для аккумуляторов и многого другого. Карбонат натрия, например, находит применение в стекловарении для изменения вязкости стекла и повышения его прозрачности.
Карбонаты щелочных металлов также являются ключевыми компонентами многих реакций в химической промышленности и научных исследованиях. Они используются в качестве реагентов для нейтрализации кислот, в процессах обезжиривания и очистки воды, а также для получения растворов нужной концентрации для проведения химических экспериментов.
Точное знание растворимости карбонатов щелочных металлов позволяет управлять химическими реакциями и процессами производства. Исследования в этой области помогают оптимизировать условия получения определенных продуктов и разрабатывать новые методы синтеза и применения карбонатов для различных целей.
Таким образом, растворимость карбонатов щелочных металлов является ключевым фактором для производства и научных исследований. Она определяет возможности использования этих соединений в различных отраслях и способы их применения для достижения нужных химических реакций и результатов.
Практическое значение растворимости карбонатов и возможность управления химическими реакциями
Растворимость карбонатов щелочных металлов имеет огромное практическое значение, так как эти соединения широко применяются в промышленности и быту. Например, гидрокарбонаты натрия и калия широко применяются в качестве антиокислителей, стабилизаторов pH и компонентов в процессе пищеварения. При этом, зная растворимость карбонатов, можно контролировать процессы образования или осаждения этих соединений.
Возможность управления химическими реакциями на основе растворимости карбонатов щелочных металлов также имеет большое значение. Например, если растворить карбонат кальция в воде, получится раствор, который может использоваться для приготовления молока из костной пудры. Кроме того, растворимость карбонатов может быть использована для регулирования pH в различных химических процессах, таких как очистка воды или производство лекарственных препаратов.
Кроме того, растворимость карбонатов имеет важное значение в процессах экстракции металлов. Например, при производстве алюминия из бокситов используется растворение карбонатов алюминия в сильно щелочной среде. Карбонаты кальция также могут быть использованы в производстве стекла и цемента, где они служат одним из основных компонентов.
Вопрос-ответ

Почему растворимость карбонатов щелочных металлов так высока?
Растворимость карбонатов щелочных металлов высока из-за их способности образовывать ионы, которые легко реагируют с водой. Карбонаты щелочных металлов образуют гидроксиды, которые являются сильными основаниями и хорошо растворимыми в воде. Это связано с ионными связями в структуре карбонатов, которые обеспечивают высокую степень поляризации и образование ионов в растворе.
Как растворимость карбонатов щелочных металлов влияет на химические реакции?
Растворимость карбонатов щелочных металлов играет важную роль во многих химических реакциях. Например, они могут использоваться в процессах нейтрализации кислот, так как образующийся гидроксид обладает щелочными свойствами и может нейтрализовать кислоту. Карбонаты щелочных металлов также могут использоваться в производстве стекла, мыла, моющих средств и других продуктов, где требуется щелочная реакция.
Какие еще особенности растворимости карбонатов щелочных металлов стоит упомянуть?
Одной из особенностей растворимости карбонатов щелочных металлов является их обратимость. Когда карбонаты щелочных металлов растворяются в воде, образуется гидроксид и углекислый газ. Однако, если добавить к раствору кислоту, происходит обратная реакция, и карбонаты восстанавливаются. Также стоит отметить, что растворимость карбонатов щелочных металлов увеличивается с увеличением температуры и уменьшается с увеличением концентрации других растворенных веществ.
