Щелочные металлы – это элементы периодической системы, которые принадлежат к первой группе: литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Одной из важнейших характеристик щелочных металлов является их реактивность в растворе кислоты. При контакте с кислотой, они образуют ионные соединения и выделяются газы.
Первым щелочным металлом является литий (Li). Обладая очень низкой ионизационной энергией, он реагирует с водой, образуя щелочные растворы. Литий является наименее реактивным из щелочных металлов в растворе кислоты, но его реакция с водой все равно сопровождается выделением водорода.
Натрий (Na) является более реактивным, чем литий. Он обладает более высокой ионизационной энергией и способен образовывать гидроксид натрия и выделяться в случае реакции с кислотой. Разлив натрия в воде становится ярким проявлением реактивности этого щелочного металла.
Калий (K), рубидий (Rb) и цезий (Cs) являются самыми реакционными щелочными металлами в растворе кислоты. Они мгновенно реагируют с водой, образуя щелочные растворы гидроксида металла и выделяясь в виде водорода. Эти реактивностью богатые элементы являются мощными окислителями и могут вызывать ожоги при контакте с кожей или слизистыми оболочками.
Основные свойства щелочных металлов

Щелочные металлы являются первой группой в периодической таблице и включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они имеют схожие свойства, их атомы обладают лишь одной валентной электронной оболочкой и химически активны.
Самым характерным свойством щелочных металлов является способность образовывать щелочные гидроксиды, т.е. щелочи, взаимодействуя с водой. Гидроксиды щелочных металлов обладают щелочными свойствами, которые проявляются в высоком рН и способности нейтрализовать кислоты.
Кроме того, щелочные металлы обладают сильными восстановительными свойствами, что делает их полезными в различных промышленных процессах, таких как производство щелочных батарей и преобразование энергии. Также щелочные металлы обладают высокой теплопроводностью и электропроводностью, что делает их важными компонентами в производстве электроники и техники.
Однако стоит отметить, что щелочные металлы являются очень реактивными и взрывоопасными, особенно при взаимодействии с водой или кислородом. Поэтому при работе с щелочными металлами необходимы специальные меры предосторожности.
Растворение щелочных металлов в воде

Щелочные металлы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), характеризуются способностью растворяться в воде. Растворение этих металлов в воде происходит в результате образования ионов гидроксида и выделения водорода.
Когда щелочный металл взаимодействует с водой, происходит быстрое разрушение поверхностного слоя металла, образуя гидроксидный ион и освобождая водород. Такая реакция обусловлена низкой степенью адгезии щелочных металлов к воде и высокой реакционной способностью гидроксидного иона.
Процесс растворения щелочных металлов в воде сопровождается выделением тепла. Такое выделение энергии может быть замечено при наблюдении реакции растворения. При этом воспламеняется выделяющийся водород и образуется щелочной гидроксид.
Гидроксиды щелочных металлов обладают высокой щелочностью. Это связано с тем, что гидроксидные ионы позволяют образовывать сильные основания. Эти основания хорошо растворяются в воде, образуя щелочные растворы, которые проявляют свою щелочность при реакции с кислотами.
Химические реакции щелочных металлов с кислотами
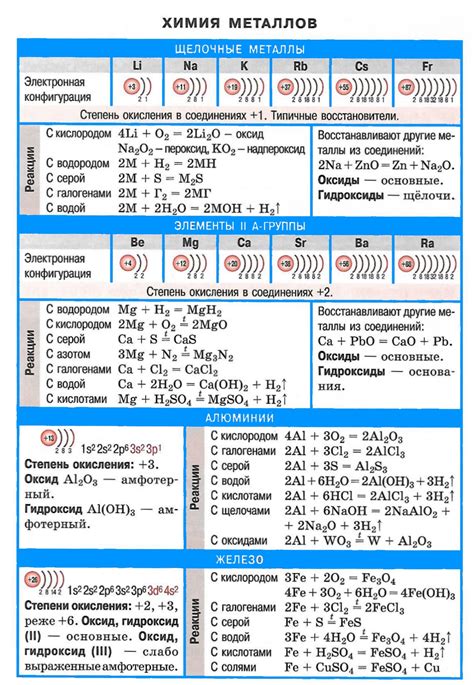
Щелочные металлы активно взаимодействуют с кислотами, образуя соли и выделяя водород. Эти реакции являются типичными для данного класса элементов и происходят на протяжении многих веков. Реакции щелочных металлов с кислотами важны с точки зрения промышленного производства солей, а также имеют огромное значение в жизни организмов и в области медицины.
Химические реакции щелочных металлов с кислотами протекают по общей схеме. В результате взаимодействия металла и кислоты образуется соль и выделяется водород. Например, при взаимодействии натрия с соляной кислотой образуется хлорид натрия и выделяется водород:
2Na + 2HCl → 2NaCl + H2
Реакции между щелочными металлами и кислотами обычно сопровождаются сильным выделением тепла и шипением. Это объясняется характерными свойствами щелочных металлов - высокой химической активностью. Благодаря своей активности, щелочные металлы легко отдают электроны и образуют положительные ионы. Именно эта особенность позволяет им реагировать с кислотами и образовывать соли.
Также следует отметить, что химические реакции щелочных металлов с кислотами могут быть опасными, особенно если речь идет о концентрированных кислотах. В таких случаях необходимо проявлять осторожность и соблюдать меры безопасности, так как может происходить высвобождение большого количества водорода и могут возникать взрывоопасные смеси.
Взаимодействие щелочных металлов с различными типами кислот

Свойства щелочных металлов в растворе кислоты определяются их химической активностью и реактивностью. Вода играет роль катализатора в реакции растворения щелочных металлов, образуя ионно-молекулярные комплексы.
Взаимодействие натрия с кислотами происходит с образованием солей и выделением водорода, что является типичной реакцией щелочных металлов с кислотами. За счет своей низкой электроотрицательности натрий легко отдаёт свой электрон и образует положительный ион, который реагирует с отрицательным ионом кислоты, образуя нейтральную соль и высвобождая молекулярный водород.
При взаимодействии калия с кислотами происходит аналогичная реакция, так как калий также отдаёт свой электрон и образует положительный ион, который реагирует с отрицательным ионом кислоты, образуя соль и выделением молекулярного водорода. Однако в этой реакции выделение водорода может проходить более интенсивно, чем при взаимодействии натрия.
Реакция растворения лития в кислоте отличается от реакций натрия и калия. Литий обладает наименьшей электроотрицательностью среди щелочных металлов. В результате взаимодействия лития с кислотами образуются соли и выделяется водород.
Таким образом, щелочные металлы обладают способностью взаимодействовать с различными типами кислот, образуя соли и выделяя водород. Вода играет важную роль в этих реакциях в качестве катализатора.
Роль щелочных металлов в реакциях нейтрализации

Щелочные металлы играют важную роль в реакциях нейтрализации, так как они обладают высокой реакционной способностью при контакте с кислотами. Когда раствор кислоты встречается с раствором щелочного металла, происходит образование соли и воды. Этот процесс называется нейтрализацией, так как с помощью щелочных металлов можно "нейтрализовать" кислоты и получить нейтральные или слабощелочные растворы.
Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и другие, способны давать ионы гидроксида (OH-) в растворе. Ионы гидроксида являются основаниями и обладают щелочными свойствами. При реакции с кислотой, ионы гидроксида принимают протоны от кислоты и образуют молекулы воды, в результате чего раствор кислоты становится нейтральным или слабощелочным.
Реакции нейтрализации с участием щелочных металлов имеют широкое применение в различных сферах. Например, они используются в химической промышленности для производства солей, нейтрализации отходов и очистки сточных вод. Также реакции нейтрализации на основе щелочных металлов применяются в медицине и бытовых целях, например, для лечения изжоги или нейтрализации кислотности в желудке.
Применение щелочных металлов в промышленности

Натрий
Щелочные металлы, в особенности натрий, широко применяются в различных отраслях промышленности. Одним из наиболее значимых применений натрия является его использование в производстве стекла. Натрий, добавленный в смесь с силикатом кремния, позволяет понизить температуру плавления и улучшить текучесть стекла. Натрий также используется в качестве добавки в производстве мыла и моющих средств, поскольку он обладает высокой щелочностью и способен эффективно очищать поверхности.
В промышленности натрий также находит применение в производстве бумаги и целлюлозы, алюминия и прочих металлов, очистке металлических поверхностей от ржавчины и окислов, а также в производстве взрывчатых веществ, стержней для фарфора и электрических проводников.
Калий
Калий является другим важным щелочным металлом, применяемым в промышленности. Одним из основных применений калия является его использование в производстве удобрений. Соляные и калийные удобрения, содержащие калий, существенно повышают плодородие почв, улучшают качество и урожайность сельскохозяйственных культур. Калий также используется в производстве стекла, мыла, жидкого мыла, а также в процессах электролитического осаждения металлов и очистки горючих жидкостей. Калийные соединения также широко применяются в фармацевтической промышленности.
Литий
Литий является наименее распространенным из щелочных металлов, однако он также находит важное применение в промышленности. В первую очередь, литий используется в производстве литиевых ионных аккумуляторов, которые являются основными источниками питания для портативной электроники, электромобилей и других устройств. Литий также применяется в металлургии при производстве алюминия и магния, а также в качестве катализатора в органическом синтезе. Благодаря своим уникальным химическим свойствам, литий также находит применение в производстве стекла, керамики и сплавов с низкой плотностью.
Вопрос-ответ

Какие свойства щелочных металлов проявляются в растворе кислоты?
Основные свойства щелочных металлов, таких как литий, натрий, калий и др., проявляются в растворе кислоты. При контакте с кислотой, эти металлы образуют ионы гидроксида и выделяются водород. Реакция между щелочным металлом и кислотой является экзотермической, то есть сопровождается выделением тепла. Помимо этого, щелочные металлы проявляют свою активность в реакциях с кислотами, что обусловлено их химической структурой и малой ионизационной энергией.
Что происходит при растворении щелочных металлов в кислоте?
При растворении щелочных металлов, таких как натрий или калий, в кислоте происходит экзотермическая реакция. Металлы образуют ионы гидроксида, которые реагируют с ионами водорода, выделяющимися при реакции. В результате образуется соль и вода. Так, например, при растворении натрия в соляной кислоте образуется натриевая соль и вода: 2Na + 2HCl = 2NaCl + H2O.
Какие реакции происходят между щелочными металлами и кислотами?
Реакции между щелочными металлами и кислотами проходят между ионами гидроксида и ионами водорода. При контакте с кислотой, щелочные металлы образуют гидроксид и выделяются ионы водорода. Например, при реакции натрия с соляной кислотой образуется хлорид натрия и вода: 2Na + 2HCl = 2NaCl + H2O. Эти реакции являются экзотермическими и сопровождаются выделением тепла.
Почему реакция между щелочными металлами и кислотами сопровождается выделением тепла?
Реакция между щелочными металлами и кислотами сопровождается выделением тепла из-за экзотермической природы этого процесса. Экзотермические реакции идут с выделением энергии в виде тепла. В данном случае, при контакте щелочных металлов с кислотами, происходит релизация химической энергии, что приводит к повышению температуры реакционной смеси.
