Металлы первой группы периодической таблицы являются одними из наиболее известных и широко распространенных металлов. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У этих элементов есть несколько общих свойств, и одним из важных является их таблица 7.
Таблица 7 представляет собой упорядоченное отображение химических элементов по возрастанию атомных номеров. Для металлов первой группы таблица 7 указывает, что у них всегда один валентный электрон. Это означает, что эти металлы легко отдают этот электрон, чтобы образовать катионы с положительным зарядом.
Постоянная валентность металлов первой группы является следствием их электронной конфигурации. Все металлы этой группы имеют один внешний s-орбитальный электрон, который легко теряется при химических реакциях. В результате они образуют катионы с зарядом +1 и образуют стабильное соединение с анионами, имеющими заряд -1. Примером может служить образование соединений между литием и хлором, образуя литийхлорид LiCl.
Свойства металлов первой группы

1. Атомный и ионный радиусы: Металлы первой группы имеют большие атомные и ионные радиусы. Это связано с наличием только одной валентной электронной оболочки, что приводит к слабому притяжению электронов к ядру. Таким образом, атомы и ионы металлов первой группы могут иметь более крупный размер по сравнению с другими металлами периодической системы.
2. Металлический блеск: Металлы первой группы обладают характерным металлическим блеском. Это связано с их способностью отражать свет, так как электроны свободно двигаются по металлической структуре.
3. Валентность: У всех металлов первой группы валентность равна одному положительному заряду. Это означает, что они образуют ионы с единичным положительным зарядом (например, Na+ или K+). Такая постоянная валентность обусловлена наличием одного электрона на валентной оболочке металла.
4. Химическая активность: Металлы первой группы химически активны и легко реагируют с другими веществами. Это связано с тем, что у них наружный электрон отделен от ядра слабо, и он легко участвует в химических реакциях, образуя ионы положительного заряда.
5. Реакция с водой: Металлы первой группы активно реагируют с водой, образуя гидроксиды и выделяя водород. Например, натрий (Na) при контакте с водой образует гидроксид натрия (NaOH) и выделяет газообразный водород. Эта реакция является очень быстрой и сопровождается выделением тепла.
6. Проводимость тепла и электричества: Металлы первой группы обладают высокой проводимостью тепла и электричества. Это обусловлено наличием свободных электронов, которые могут свободно перемещаться внутри металлической структуры и переносить тепло и электричество.
7. Способность образовывать соли: Благодаря постоянной валентности и легкой реактивности, металлы первой группы легко образуют соли с отрицательно заряженными ионами. Например, натрий (Na) образует соль хлорида натрия (NaCl) с хлоридным ионом (Cl-).
Итак, металлы первой группы обладают такими свойствами, как большие атомные и ионные радиусы, металлический блеск, постоянную валентность, высокую химическую активность, способность реагировать с водой, высокую проводимость тепла и электричества, а также способность образовывать соли. Эти свойства делают металлы первой группы важными и полезными в различных областях промышленности и науке.
Металлы первой группы

Металлы первой группы периодической системы являются самыми активными металлами. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Одной из основных характеристик металлов первой группы является постоянная валентность. Это означает, что все элементы этой группы всегда образуют ион с одной валентностью, равной единице. Например, ионы лития всегда имеют заряд +1, натрия - +1, калия - +1 и т.д.
Металлы первой группы обладают высокой реактивностью и способностью образовывать ионы положительной валентности. Это связано с тем, что в этих металлах наружный электронный уровень заполнен только одним электроном, который легко отдается при взаимодействии с другими элементами. Из-за своей высокой реактивности, металлы первой группы не встречаются в природе в свободном состоянии, а только в виде соединений с другими элементами.
Также металлы первой группы характеризуются низкой плотностью, низкой температурой плавления и высокой проводимостью электричества и тепла. Они являются хорошими проводниками электричества и широко используются в электронике и электротехнике.
Таблица 7 в периодической системе химических элементов представляет свойства металлов первой группы. В этой таблице указаны атомный номер, символ элемента, среднюю атомную массу, электронную конфигурацию и основные химические свойства.
Таблица 7 элементов
Таблица 7 элементов представляет собой список металлов первой группы периодической системы Менделеева. Эта группа включает в себя следующие элементы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs), франций (Fr) и новейший добавленный элемент, названный временно унунсептий (Uus).
Металлы первой группы обладают рядом общих химических свойств. Одно из основных свойств этих элементов - постоянная валентность, которая составляет +1. Это означает, что при образовании химических соединений эти металлы всегда отдают один электрон.
Кроме того, металлы первой группы легко реагируют с водой, выделяя водород. Они также образуют соли с кислотами, что делает их важными элементами для промышленности. Более того, металлы первой группы имеют низкую плотность, низкую температуру плавления и высокую электропроводность.
Таблица 7 элементов позволяет легко ориентироваться в свойствах металлов первой группы и помогает уяснить, какие элементы имеют сходные химические свойства и как они взаимодействуют с другими элементами.
Химические свойства

Металлы первой группы характеризуются высокой химической активностью. Они обладают одной валентностью, равной +1.
Взаимодействуя с кислородом, металлы первой группы образуют оксиды, например, оксид натрия (Na2O), оксид калия (K2O) и оксид лития (Li2O). Эти оксиды являются щелочными и образуют щелочные растворы.
Металлы первой группы способны реагировать с водой, образуя гидроксиды. Например, взаимодействие натрия с водой приводит к образованию гидроксида натрия (NaOH) и выделению водорода.
Реакция металлов первой группы с кислотами приводит к выделению водорода. Например, взаимодействие натрия с соляной кислотой (HCl) приводит к образованию хлорида натрия (NaCl) и выделению водорода.
Металлы первой группы обладают высокой реакционной способностью, что позволяет им присоединяться к другим элементам и образовывать различные соединения.
Физические свойства

Металлы первой группы элементов характеризуются рядом физических свойств, которые определяют их уникальные характеристики и применение в различных отраслях промышленности.
Одной из основных физических характеристик металлов первой группы является высокая электропроводность. Это означает, что электроны в этих металлах могут свободно двигаться, что делает их отличными проводниками электрического тока.
Вторым важным свойством является высокая теплопроводность. Металлы первой группы быстро передают тепло, что делает их идеальными материалами для использования в теплообменных устройствах, например, радиаторах и теплообменниках.
Одним из наиболее ярких физических свойств металлов первой группы является их блеск. Этот эффект, известный как металлический блеск, объясняется свободным движением электронов, которые отражают свет и создают характерный глянец на поверхности металла.
Еще одним важным физическим свойством металлов первой группы является их высокая плотность. Металлы этой группы обладают большим весом на единицу объема, что делает их прочными и устойчивыми к механическим воздействиям.
Также стоит отметить, что металлы первой группы характеризуются низкой температурой плавления и кипения, что делает их подходящими для использования в различных процессах пайки и сварки.
Постоянная валентность
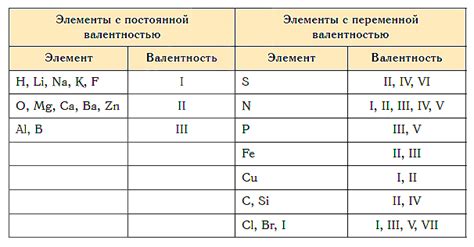
Постоянная валентность – это свойство химических элементов металлов первой группы сохранять постоянное значение своей валентности во всех своих соединениях. Валентность – это количество электронов, которые атом может отдать или принять при образовании химической связи.
Металлы первой группы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr), обладают постоянной валентностью +1. Это означает, что все эти элементы готовы отдать один электрон, чтобы образовать ион, имеющий положительный заряд.
Постоянная валентность металлов первой группы обусловлена их электронной конфигурацией. Все эти элементы имеют один валентный электрон в своей внешней электронной оболочке, которая состоит из одной s-орбитали. При реакциях эти металлы предпочитают потерять этот один электрон, чтобы стать стабильными, образуя положительные ионы с 1+ зарядом.
Потеря одного электрона и образование иона с 1+ зарядом позволяет металлам первой группы достичь симметрии электрических зарядов в своей внешней электронной оболочке. Это делает металлы первой группы стабильными и химически активными, что позволяет им образовывать легко растворимые ионы в воде и множество химических соединений.
Постоянная валентность металлов первой группы имеет важное значение для предсказания и понимания их химического поведения и свойств. Она позволяет установить общие закономерности в реактивности и соединительной способности этих элементов, что существенно упрощает их изучение и применение в различных областях науки и техники.
Вопрос-ответ

Какие свойства обладают металлы первой группы?
Металлы первой группы, такие как литий, натрий, калий, рубидий и цезий, обладают рядом характерных свойств: высокой электропроводностью, металлическим блеском, характерным оттенком и низкой температурой плавления и кипения.
Что такое таблица семь в свойствах металлов первой группы?
Таблица семь представляет собой табличное представление элементов металлов первой группы, где указывается их символ, атомный номер, валентность и другие химические характеристики.
Какая валентность металлов первой группы и почему она постоянна?
Металлы первой группы имеют постоянную валентность, равную +1. Это обусловлено наличием у них одного электрона во внешней энергетической оболочке. Такая конфигурация обуславливает стабильность атомов и их способность отдавать один электрон при взаимодействии с другими элементами.
Какие элементы относятся к металлам первой группы?
Металлами первой группы являются литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Они отличаются своими химическими и физическими свойствами, но обладают общими чертами, такими как низкая температура плавления, высокая электропроводность и постоянная валентность.
Какие еще свойства металлов первой группы можно выделить?
Помимо высокой электропроводности и низкой температуры плавления, металлы первой группы обладают такими свойствами, как реакционная способность, образование щелочных оксидов и гидроксидов, характерный блеск, низкая плотность и возможность образования ионов с положительно заряженным электронным венцом.
