В данной статье мы рассмотрим процесс разложения нитрата металла и рассчитаем объем газа, который образуется при данной реакции. Для расчета будем использовать данные о массе нитрата металла, которую мы получили - 44,75 г. Перед тем как рассчитать объем газа, давайте вспомним, что такое нитрат металла. Нитрат металла - это соль, образованная из металла и ионов нитрата. Под действием тепла или других реактивов нитрат металла может разлагаться на металл и газы. Для расчета объема газа, образующегося при разложении 44,75 г нитрата металла, нужно знать соотношение между массой нитрата металла и объемом газа. Для этого можно воспользоваться химическим уравнением реакции разложения нитрата металла и соотношением между количеством веществ в реакции. Таким образом, для расчета объема газа нам необходимо узнать количество вещества нитрата металла, а затем использовать соответствующий коэффициент пропорциональности, чтобы перейти от количества вещества к объему газа.
Как рассчитать объем газа в литрах при разложении нитрата металла?
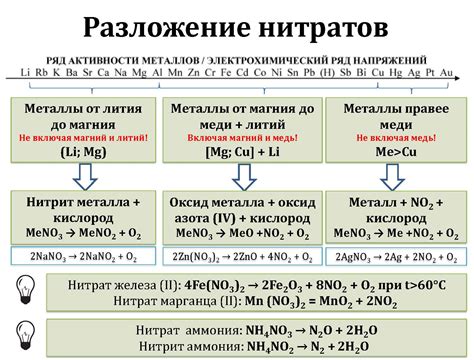
 Разложение нитрата металла является реакцией, при которой образуется газ. Для расчета объема этого газа необходимо учесть несколько факторов. Во-первых, необходимо знать химическое уравнение реакции разложения нитрата металла. В данном уравнении указываются реагенты, их стехиометрические коэффициенты и продукты реакции.
Разложение нитрата металла является реакцией, при которой образуется газ. Для расчета объема этого газа необходимо учесть несколько факторов. Во-первых, необходимо знать химическое уравнение реакции разложения нитрата металла. В данном уравнении указываются реагенты, их стехиометрические коэффициенты и продукты реакции.  Во-вторых, необходимо определить количество вещества нитрата металла, которое участвует в реакции. Для этого используют массу вещества и молярную массу нитрата металла. Зная количество вещества нитрата металла, можно использовать его стехиометрический коэффициент в химическом уравнении, чтобы рассчитать количество образовавшегося газа. Для перевода количества вещества газа в объем необходимо знать его условия (температура и давление). Обычно данные условия указываются в задаче. Если это не указано, можно использовать стандартные условия — 0°C и 1 атм. С помощью уравнения состояния идеального газа (уравнения Клапейрона) и данных о температуре и давлении можно рассчитать объем газа в литрах. Ниже приведен пример расчета объема газа при разложении 44,75 г нитрата металла с использованием указанных шагов:
Во-вторых, необходимо определить количество вещества нитрата металла, которое участвует в реакции. Для этого используют массу вещества и молярную массу нитрата металла. Зная количество вещества нитрата металла, можно использовать его стехиометрический коэффициент в химическом уравнении, чтобы рассчитать количество образовавшегося газа. Для перевода количества вещества газа в объем необходимо знать его условия (температура и давление). Обычно данные условия указываются в задаче. Если это не указано, можно использовать стандартные условия — 0°C и 1 атм. С помощью уравнения состояния идеального газа (уравнения Клапейрона) и данных о температуре и давлении можно рассчитать объем газа в литрах. Ниже приведен пример расчета объема газа при разложении 44,75 г нитрата металла с использованием указанных шагов:- Нитрат металла: X(NO3)n
- Химическое уравнение: X(NO3)n → XOm + NO2 + O2
- Молярная масса нитрата металла: М(NO3)n
- Количество вещества нитрата металла: n = масса / М
- Стехиометрический коэффициент газа: m
- Количество газа: n * m
- Объем газа в литрах: V = (n * m * R * T) / P
Определение молярной массы нитрата металла
 Молярная масса нитрата металла является важной характеристикой данного соединения. Для определения молярной массы нитрата металла необходимо узнать массу одного моля данного соединения. Это позволит провести различные расчеты, связанные с количеством вещества и объемом газа, создаваемого при его разложении. Для расчета молярной массы нитрата металла необходимо учесть атомные массы всех его составляющих элементов. Нитрат металла представляет собой соединение, состоящее из атомов металла, атомов азота и кислородных ионов. Атомные массы этих элементов известны и могут быть найдены в периодической системе элементов.
Молярная масса нитрата металла является важной характеристикой данного соединения. Для определения молярной массы нитрата металла необходимо узнать массу одного моля данного соединения. Это позволит провести различные расчеты, связанные с количеством вещества и объемом газа, создаваемого при его разложении. Для расчета молярной массы нитрата металла необходимо учесть атомные массы всех его составляющих элементов. Нитрат металла представляет собой соединение, состоящее из атомов металла, атомов азота и кислородных ионов. Атомные массы этих элементов известны и могут быть найдены в периодической системе элементов.  Например, для определения молярной массы нитрата кальция (Ca(NO3)2), необходимо сложить атомные массы кальция (Ca), азота (N) и кислорода (O) в соответствующих пропорциях, учитывая количество каждого элемента в молекуле нитрата кальция. Получившееся значение будет выражать массу одного моля нитрата кальция. Определение молярной массы нитрата металла позволяет провести расчеты, связанные с количеством образующегося газа при разложении данного соединения. Для этого необходимо знать молярную массу и провести расчет, используя химическую уравнение реакции и принцип стехиометрии. Таким образом, определение молярной массы нитрата металла является важным этапом при проведении химических расчетов, связанных с его разложением и образованием газа. Корректный расчет позволяет получить точные значения количества вещества и объема газа, создаваемого при разложении нитрата металла.
Например, для определения молярной массы нитрата кальция (Ca(NO3)2), необходимо сложить атомные массы кальция (Ca), азота (N) и кислорода (O) в соответствующих пропорциях, учитывая количество каждого элемента в молекуле нитрата кальция. Получившееся значение будет выражать массу одного моля нитрата кальция. Определение молярной массы нитрата металла позволяет провести расчеты, связанные с количеством образующегося газа при разложении данного соединения. Для этого необходимо знать молярную массу и провести расчет, используя химическую уравнение реакции и принцип стехиометрии. Таким образом, определение молярной массы нитрата металла является важным этапом при проведении химических расчетов, связанных с его разложением и образованием газа. Корректный расчет позволяет получить точные значения количества вещества и объема газа, создаваемого при разложении нитрата металла.Расчет количества вещества нитрата металла
 Для расчета количества вещества нитрата металла необходимо знать молярную массу данного соединения. Молярная масса выражается в граммах на моль и позволяет определить количество частиц вещества. Для примера рассмотрим нитрат металла с массой 44,75 г. Для начала необходимо установить, о каком металле идет речь. Затем, используя таблицу молярных масс элементов, определить молярную массу этого металла. Зная молярную массу металла, можно рассчитать количество молей нитрата металла, разделив массу вещества на молярную массу: Количество молей = Масса вещества / Молярная масса После рассчитывается количество частиц вещества в моле. Однако, в данной задаче требуется выразить результат в объеме, поэтому дополнительно нужно знать плотность газа, образующегося при разложении нитрата металла. С помощью плотности возможно рассчитать объем газа, используя следующую формулу: Объем газа = Количество молей газа * Молярный объем газа Таким образом, для полного расчета объема газа, образующегося при разложении 44,75 г нитрата металла, необходимо знать молярную массу металла и плотность газа, а также учесть условия задачи.
Для расчета количества вещества нитрата металла необходимо знать молярную массу данного соединения. Молярная масса выражается в граммах на моль и позволяет определить количество частиц вещества. Для примера рассмотрим нитрат металла с массой 44,75 г. Для начала необходимо установить, о каком металле идет речь. Затем, используя таблицу молярных масс элементов, определить молярную массу этого металла. Зная молярную массу металла, можно рассчитать количество молей нитрата металла, разделив массу вещества на молярную массу: Количество молей = Масса вещества / Молярная масса После рассчитывается количество частиц вещества в моле. Однако, в данной задаче требуется выразить результат в объеме, поэтому дополнительно нужно знать плотность газа, образующегося при разложении нитрата металла. С помощью плотности возможно рассчитать объем газа, используя следующую формулу: Объем газа = Количество молей газа * Молярный объем газа Таким образом, для полного расчета объема газа, образующегося при разложении 44,75 г нитрата металла, необходимо знать молярную массу металла и плотность газа, а также учесть условия задачи.Применение закона Гей-Люссака для расчета объема газа
 Закон Гей-Люссака, также известный как закон пропорциональности объема газов к их коэффициентам стехиометрии, является одним из фундаментальных законов газовой химии. Он позволяет рассчитать объем газа, в котором происходит газообразная реакция, и основан на наблюдении, что объемы реагирующих газов и образующихся газов имеют простые числовые соотношения при постоянных условиях давления и температуры. Для применения закона Гей-Люссака необходимо знать стехиометрический коэффициент реагента, который подвергается разложению, и коэффициент реагента, образующегося в результате реакции. Эти коэффициенты можно найти в химическом уравнении реакции.
Закон Гей-Люссака, также известный как закон пропорциональности объема газов к их коэффициентам стехиометрии, является одним из фундаментальных законов газовой химии. Он позволяет рассчитать объем газа, в котором происходит газообразная реакция, и основан на наблюдении, что объемы реагирующих газов и образующихся газов имеют простые числовые соотношения при постоянных условиях давления и температуры. Для применения закона Гей-Люссака необходимо знать стехиометрический коэффициент реагента, который подвергается разложению, и коэффициент реагента, образующегося в результате реакции. Эти коэффициенты можно найти в химическом уравнении реакции.  Для расчета объема газа, образующегося при реакции, необходимо знать массу реагента, который подвергается разложению. Используя молярную массу данного вещества, можно перевести массу в количество вещества, выразив его в молях. Известное количество вещества связано с объемом газа с помощью молярного объема, который для идеального газа при нормальных условиях равен 22,4 литра. Исходя из этого, можно рассчитать объем газа, образующегося при разложении реагента, используя пропорцию между количеством вещества и объемом. Например, для расчета объема газа, образующегося при разложении 44,75 г нитрата металла, необходимо знать химическое уравнение реакции, молярную массу нитрата металла и коэффициенты стехиометрии реакции. Подставив эти значения в уравнение Гей-Люссака, можно рассчитать искомый объем газа в литрах.
Для расчета объема газа, образующегося при реакции, необходимо знать массу реагента, который подвергается разложению. Используя молярную массу данного вещества, можно перевести массу в количество вещества, выразив его в молях. Известное количество вещества связано с объемом газа с помощью молярного объема, который для идеального газа при нормальных условиях равен 22,4 литра. Исходя из этого, можно рассчитать объем газа, образующегося при разложении реагента, используя пропорцию между количеством вещества и объемом. Например, для расчета объема газа, образующегося при разложении 44,75 г нитрата металла, необходимо знать химическое уравнение реакции, молярную массу нитрата металла и коэффициенты стехиометрии реакции. Подставив эти значения в уравнение Гей-Люссака, можно рассчитать искомый объем газа в литрах.Перевод объема газа в литры
 При решении химических задач часто необходимо расчитать объем газа, который образуется в ходе химической реакции. Объем газа обычно измеряется в литрах (л), поэтому важно знать, как перевести данные о объеме газа из других единиц измерения в литры. Один из способов перевода объема газа в литры основан на использовании уравнения состояния идеального газа. Согласно этому уравнению, объем газа прямо пропорционален количеству вещества газа и обратно пропорционален его плотности. Чтобы перевести объем газа из других единиц измерения в литры, необходимо сначала определить количество вещества газа в молях. Для этого можно использовать данное количество газа и молярную массу вещества. Затем следует использовать соотношение между количеством вещества газа и его объемом, чтобы найти объем в литрах. Это соотношение можно получить из уравнения состояния идеального газа. Например, если дано количество газа в молекулах или молях, можно использовать соотношение 1 моль газа = 22,4 литра газа при стандартных условиях (0°С, 1 атм). Далее, можно использовать пропорцию для перевода данного объема газа в другие единицы измерения. Подводя итог, перевод объема газа в литры требует знания количества вещества газа и его плотности. С использованием уравнения состояния идеального газа и соответствующих соотношений, можно легко выполнить этот перевод и получить значение объема газа в литрах.
При решении химических задач часто необходимо расчитать объем газа, который образуется в ходе химической реакции. Объем газа обычно измеряется в литрах (л), поэтому важно знать, как перевести данные о объеме газа из других единиц измерения в литры. Один из способов перевода объема газа в литры основан на использовании уравнения состояния идеального газа. Согласно этому уравнению, объем газа прямо пропорционален количеству вещества газа и обратно пропорционален его плотности. Чтобы перевести объем газа из других единиц измерения в литры, необходимо сначала определить количество вещества газа в молях. Для этого можно использовать данное количество газа и молярную массу вещества. Затем следует использовать соотношение между количеством вещества газа и его объемом, чтобы найти объем в литрах. Это соотношение можно получить из уравнения состояния идеального газа. Например, если дано количество газа в молекулах или молях, можно использовать соотношение 1 моль газа = 22,4 литра газа при стандартных условиях (0°С, 1 атм). Далее, можно использовать пропорцию для перевода данного объема газа в другие единицы измерения. Подводя итог, перевод объема газа в литры требует знания количества вещества газа и его плотности. С использованием уравнения состояния идеального газа и соответствующих соотношений, можно легко выполнить этот перевод и получить значение объема газа в литрах.Вопрос-ответ

Как рассчитать объем газа, который образуется при разложении нитрата металла?
Для расчета объема газа, образующегося при разложении нитрата металла, необходимо знать молярную массу нитрата металла (которую можно найти в таблице молярных масс) и использовать закон Авогадро. Сначала найдите число молей нитрата металла, разделив массу нитрата на его молярную массу. Затем, используя коэффициенты в сбалансированном химическом уравнении разложения нитрата, определите, сколько молей газа образуется. Наконец, умножьте это количество на объем одного моля газа (который примерно равен 22,4 литрам) для получения объема газа, образующегося при разложении нитрата металла.
Как найти молярную массу нитрата металла?
Чтобы найти молярную массу нитрата металла, необходимо сложить массы атомов всех элементов в нитрате с учетом их стехиометрических коэффициентов. Например, для нитрата металла, содержащего атомы металла, азота и кислорода, нужно найти массы каждого атома этих элементов и сложить их в определенных пропорциях согласно формуле нитрата металла. Молярная масса выражается в г/моль и можно найти в таблице молярных масс химических элементов или соединений.
