Распределение электронов по энергетическим уровням щелочных металлов – одна из ключевых тем в химии и физике. Щелочные металлы (литий, натрий, калий, рубидий, цезий и франций) представляют собой группу элементов с характерными свойствами, такими как низкая плотность, низкая температура плавления и сильная химическая реакционность. Эти свойства основываются на специфическом электронном строении атомов щелочных металлов.
Атомы щелочных металлов имеют одну электронную оболочку с одним электроном на s-орбитали. Этот электрон находится на самом низком, или основном, энергетическом уровне. Основной энергетический уровень является наиболее стабильным для атома щелочного металла и определяет его основные химические свойства. Этот электрон готов отдать или получить один электрон, что делает атомы щелочных металлов химически реакционными и способными образовывать ионы с положительным зарядом.
Распределение электронов по энергетическим уровням щелочных металлов имеет значительное значение для понимания их химических свойств и способности образовывать соединения. При реакциях щелочные металлы стремятся достигнуть электронной конфигурации нобелевых газов (группа инертных газов с полностью заполненными электронными оболочками) путем передачи своего одного электрона или приема одного электрона. Это позволяет щелочным металлам образовывать стабильные соединения с другими элементами и выполнять важные химические реакции.
Изучение распределения электронов по энергетическим уровням щелочных металлов имеет не только академическое, но и практическое значение. Знание электронной структуры щелочных металлов позволяет предсказывать и объяснять их химическое поведение, включая способность образовывать ионы, реактивность и реакции с другими веществами. Это знание находит применение в различных областях, от синтеза новых соединений до производства батарей и лекарственных препаратов.
Распределение электронов

Распределение электронов по энергетическим уровням щелочных металлов является важной особенностью этих элементов. Щелочные металлы, такие как литий, натрий, калий и др., относятся к первой группе периодической системы и имеют один электрон в своей внешней оболочке.
Этот электрон может находиться на разных энергетических уровнях, которые могут быть представлены атомной орбиталью s. Распределение электронов по энергетическим уровням осуществляется в соответствии с принципами заполнения электронных оболочек. Сначала электроны заполняют орбитали с наименьшей энергией, а затем двигаются к более высоким энергетическим уровням.
У щелочных металлов имеется одна внешняя оболочка, которая содержит одну орбиталь s. Это означает, что каждый щелочный металл имеет один электрон в своей внешней оболочке, который может находиться на энергетическом уровне s. Это делает их очень реактивными элементами, так как электрону во внешней оболочке легко перемещаться и участвовать в химических реакциях.
Стоит отметить, что есть некоторые закономерности в распределении электронов по энергетическим уровням. Например, первые две группы щелочных металлов (группы 1 и 2) имеют аналогичное распределение электронов в своих внешних оболочках. Первая группа имеет один электрон на энергетическом уровне s, в то время как вторая группа имеет два электрона - один на энергетическом уровне s и один на энергетическом уровне p.
Основные принципы
Распределение электронов по энергетическим уровням щелочных металлов определяется основными принципами квантовой механики и электронной структуры атомов.
В соответствии с принципами Паули, каждый электрон должен занимать свободное место на доступном энергетическом уровне и иметь противоположный спин. Это означает, что на каждом энергетическом уровне может находиться максимум два электрона с разными значениями спина - "вверх" и "вниз".
Согласно правилу Хунда, электроны заполняют энергетические уровни в порядке возрастания их энергии. Сначала заполняются наименьшие энергетические уровни, а затем постепенно переходят на более высокие уровни. Это объясняет, почему щелочные металлы имеют определенное число электронов на каждом энергетическом уровне.
Другим важным принципом является правило заполнения, согласно которому электроны сначала заполняют подуровни с более низкой энергией, прежде чем перейти к более высоким энергетическим уровням. Это может объяснить, почему у щелочных металлов наружная оболочка часто содержит один электрон, который находится на s-подуровне.
В целом, понимание основных принципов распределения электронов по энергетическим уровням щелочных металлов позволяет более глубоко изучить их химические свойства и реактивность.
Энергетические уровни
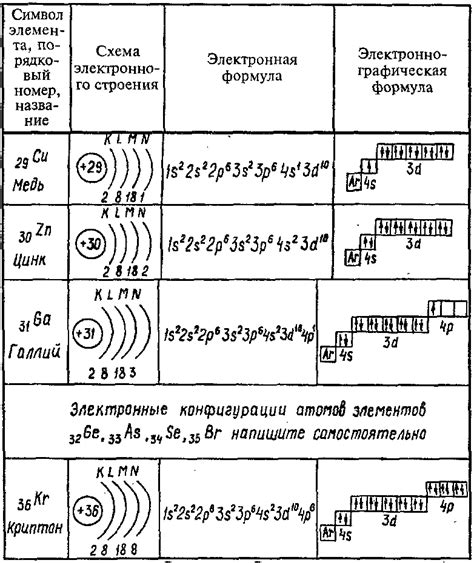
Энергетические уровни щелочных металлов представляют собой различные уровни энергии, на которых могут находиться электроны в атоме. Каждый энергетический уровень обладает определенной энергией и может вместить определенное количество электронов.
Наиболее низкий энергетический уровень называется основным уровнем. Остальные уровни называются возбужденными уровнями, поскольку электроны могут переходить на более высокие уровни, получая дополнительную энергию.
Распределение электронов по энергетическим уровням происходит в соответствии с принципами заполнения электронных оболочек. По правилу паули каждый энергетический уровень может вмещать не более двух электронов, с противоположными спинами. По принципу группировки электроны заполняют уровни таким образом, чтобы создать максимально стабильную конфигурацию атома.
Энергетические уровни щелочных металлов играют важную роль в химических реакциях, поскольку они определяют активность этих металлов. Щелочные металлы обладают одним электроном на внешнем энергетическом уровне, что делает их химически активными и склонными образовывать ионные соединения с другими элементами.
Значение для щелочных металлов

Распределение электронов по энергетическим уровням имеет важное значение для щелочных металлов, таких как литий, натрий, калий и др.
Первый энергетический уровень – с наименьшей энергией – обладает одним электроном, остальные электроны распределены по последующим уровням, при условии что количество электронов на каждом уровне не превышает максимального значения. Это определяет химические свойства и поведение щелочных металлов в реакциях.
Распределение электронов в энергетических уровнях позволяет щелочным металлам образовывать ионы, т.е. атомы с положительным или отрицательным зарядом. Это делает их реактивными и способными образовывать разнообразные химические соединения.
Благодаря распределению электронов по энергетическим уровням, щелочные металлы обладают активностью и способностью образовывать стабильные соединения не только с другими металлами, но и с неметаллами. Это делает их важными компонентами в различных процессах их применения, включая производство проточных батарей, взрывчатых веществ, солей и щелочных растворов.
Роль в химических реакциях
Распределение электронов по энергетическим уровням щелочных металлов играет важную роль в химических реакциях. Щелочные металлы, такие как литий, натрий, калий и другие, имеют одну валентную электронную оболочку, которая легко участвует в обмене электронами с другими атомами.
Эта одна валентная электронная оболочка в щелочных металлах делает их очень реакционноспособными, потому что они стремятся либо передать свою валентную электронную оболочку, чтобы стать положительно заряженным ионом, либо получить электроны от других атомов и стать отрицательно заряженным ионом.
Это распределение электронов позволяет щелочным металлам образовывать химические связи с другими элементами и участвовать в реакциях образования соединений. Они могут образовывать соли, оксиды и гидроксиды, которые используются в различных промышленных процессах.
Например, щелочные металлы могут реагировать с водой, образуя гидроксиды и высвобождая водород. Эта реакция основана на передаче электрона от металла к воде. Также щелочные металлы могут образовывать соли с кислотами, где происходит обмен электронами.
В целом, распределение электронов в щелочных металлах определяет их химическую активность и важность в различных химических реакциях.
Вопрос-ответ

Каким образом происходит распределение электронов по энергетическим уровням щелочных металлов?
Распределение электронов по энергетическим уровням щелочных металлов происходит в соответствии с правилом заполнения электронных оболочек. Согласно этому правилу, электроны сначала заполняют уровни с наименьшей энергией, а затем переходят на уровни с более высокой энергией. В щелочных металлах наиболее низкий энергетический уровень называется s-уровнем, и он заполняется первым. Затем заполняются p-уровни, а затем d- и f-уровни для более тяжелых щелочных металлов.
Какое значение имеет распределение электронов по энергетическим уровням щелочных металлов?
Распределение электронов по энергетическим уровням щелочных металлов имеет большое значение для объяснения их химических свойств и реакций. Количество электронов на каждом уровне определяет химическую активность металла и его способность образовывать соединения. Распределение электронов также влияет на физические свойства металлов, такие как пластичность и проводимость электричества.
