Атом металла - это электронно-ядерная система, в которой электроны находятся вокруг ядра. Количество электронов в атоме зависит от атомного номера элемента в периодической системе химических элементов. Каждый атом имеет определенное количество энергетических уровней, на которых могут находиться электроны.
Распределение электронов по энергетическим уровням атома металла осуществляется в соответствии с принципами заполнения энергетических уровней. Согласно правилу, известному как принцип заполнения электронных оболочек, на первом энергетическом уровне может находиться не более 2 электронов, на втором - не более 8, на третьем - не более 18, и так далее.
Электроны вносят вклад в свойства металлов, такие как проводимость электричества и тепла. Их распределение по энергетическим уровням влияет на возможность образования связей с другими атомами и создание кристаллической решетки. Кроме того, распределение электронов в атоме металла также определяет химическую реактивность и электронные уровни молекул, которые образуются при образовании соединений с другими элементами.
Электроны в атоме металла
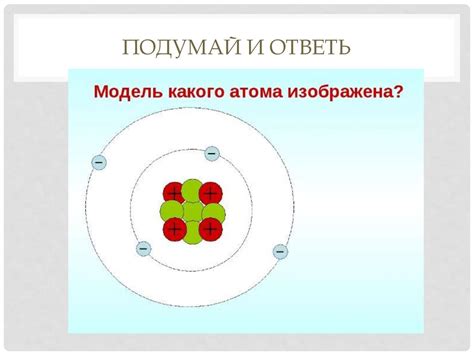
Электроны в атоме металла являются основными носителями электрического заряда. Они обладают как частицами, так и волновыми свойствами. Распределение электронов по энергетическим уровням в атоме металла определяется квантовой механикой.
Металлический атом состоит из ядра и облака электронов, которое окружает ядро. По модели Бора, эти электроны распределены по орбитам с определенными энергетическими уровнями. Ядро атома содержит протоны и нейтроны, и оно имеет положительный заряд, равный сумме зарядов протонов.
Электроны в атоме металла могут находиться на разных энергетических уровнях, которые называются энергетическими оболочками. Каждая оболочка может вмещать определенное количество электронов. Первая оболочка может вмещать до 2 электронов, вторая - до 8 электронов, третья - до 18 электронов и так далее.
Электроны внешней оболочки атома металла называются валентными электронами. Именно они определяют химические свойства металла. Количество валентных электронов может варьироваться для разных металлов. Например, у железа валентностей электронов - 2, а у алюминия - 3.
Распределение электронов по энергетическим уровням атома металла имеет важное значение для понимания его свойств и возможности взаимодействия с другими веществами. Изучение электронной структуры металлов является основой для разработки новых материалов и применения их в различных технических и научных областях.
Составление электронной конфигурации

Электронная конфигурация атома металла определяет, как распределены его электроны по энергетическим уровням. Корректное составление электронной конфигурации позволяет определить не только количество электронов на каждом энергетическом уровне, но и порядок их заполнения.
Для составления электронной конфигурации атома металла необходимо знать его атомное число. Начиная с наименьшего энергетического уровня, поэтапно распределяются электроны по последующим уровням в соответствии с правилами электронного строения.
Правило заполнения энергетических уровней:
- Энергетические уровни заполняются по возрастанию энергии.
- Каждый энергетический уровень может вместить определенное количество электронов, определяемое формулой 2n^2, где n - номер энергетического уровня.
- На каждом энергетическом уровне сначала заполняются орбитали с меньшей энергией, а затем с более высокой.
- Электроны одной орбитали должны иметь противоположные спины.
Электронную конфигурацию атома металла можно представить в виде последовательности чисел и символов. Каждое число обозначает энергетический уровень, а символы обозначают орбитали и количество электронов в них.
Например, электронная конфигурация атома кальция (Z = 20): 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2. Из этой записи можно определить, что атом кальция имеет 2 электрона на 1s-орбитали, 2 электрона на 2s-орбитали, 6 электронов на 2p-орбитали, 2 электрона на 3s-орбитали и 6 электронов на 3p-орбитали.
Составление электронной конфигурации позволяет проводить дальнейшие изучения атомов металла, такие как определение химических свойств и взаимодействия с другими веществами.
Энергетические уровни и подуровни атома
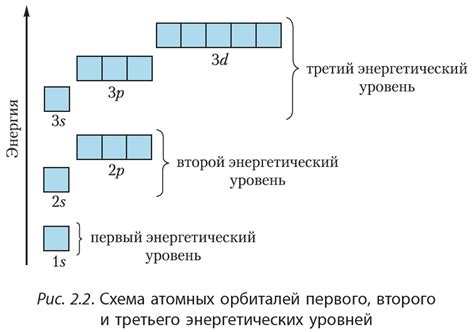
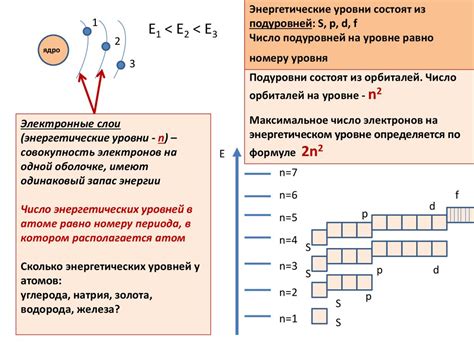
Энергетические уровни и подуровни атома являются ключевыми компонентами его электронной структуры. Энергетический уровень представляет собой определенную энергию, на которой могут находиться электроны атома. Они разделены на подуровни, которые, в свою очередь, могут быть разделены на орбитали.
Энергетические уровни обозначаются целыми числами, начиная с 1 и продолжаясь дальше. Уровень 1 наиболее близкий к ядру атома и имеет наименьшую энергию, а каждый последующий уровень имеет более высокую энергию. Электроны могут находиться только на одном из этих уровней, не в промежутках между ними.
Подуровни обозначаются латинскими буквами s, p, d и f. Подуровни s состоят из одной орбитали, p из трех орбиталей, d - из пяти орбиталей, а f - из семи орбиталей. Каждая орбиталь может содержать до двух электронов, имеющих противоположные спины.
Орбитали образуют шаблоны, в которых можно представить местоположение электронов в атоме. Существует четыре основные формы орбиталей: сферическая s-орбиталь, двояковыпуклая p-орбиталь, трехфолдно симметричная d-орбиталь и пятифолдно симметричная f-орбиталь.
Распределение электронов по энергетическим уровням и подуровням определяет химические свойства атома и его взаимодействие с другими атомами. Например, полностью заполненные энергетические уровни и подуровни имеют высокую стабильность и низкую реактивность, в то время как неполные уровни и подуровни обычно проявляют большую активность и способность к образованию химических соединений.
Основной энергетический уровень

Основной энергетический уровень в атоме металла является первым и наиболее низким уровнем энергии, на котором могут находиться электроны. На этом уровне электроны имеют наименьшую энергию и наибольшую близость к ядру атома.
Количество электронов, распределенных на основном энергетическом уровне, определяется атомным номером металла. На основном энергетическом уровне может находиться до 2n^2 электронов, где n - главное квантовое число атома.
Основной энергетический уровень можно представить в виде схемы, на которой электроны располагаются в подуровнях s и p. Электроны на основном энергетическом уровне будут занимать свободные места в этих подуровнях согласно принципу заполнения электронных оболочек, который предписывает постепенное заполнение подуровней в порядке возрастания энергии.
На основном энергетическом уровне расположены самые близкие к ядру атома металла электроны, что делает этот уровень важным для химического взаимодействия металла с другими веществами. Именно эти электроны на основном энергетическом уровне определяют химические свойства и реакционную способность металла.
Внутренние и внешние энергетические уровни
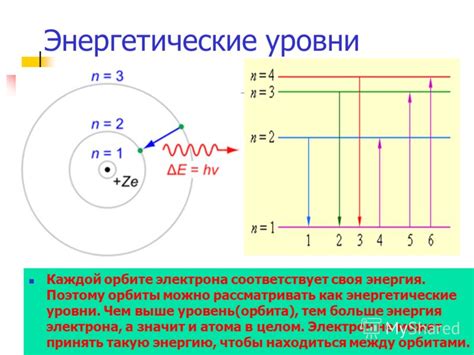
Распределение электронов по энергетическим уровням атома металла происходит в соответствии с принципами квантовой механики. Каждый атом металла имеет набор энергетических уровней, на которых располагаются электроны. Эти уровни можно разделить на две категории: внутренние и внешние.
Внутренние энергетические уровни находятся ближе к ядру атома металла. На этих уровнях располагаются электроны, имеющие самую низкую энергию. Электроны на внутренних уровнях обладают наибольшей стабильностью и слабо участвуют в химических реакциях. Эти электроны находятся в более плотной области пространства вокруг ядра и могут быть квантово-механически описаны определенными энергетическими состояниями.
Внешние энергетические уровни располагаются наружу от внутренних уровней и имеют более высокую энергию. На этих уровнях располагаются электроны, участвующие в химических реакциях и связывающие атомы металла с другими атомами при образовании соединений. Внешние электроны имеют более свободную структуру и легко подвергаются влиянию внешних факторов, таких как электрическое или магнитное поле.
Распределение электронов по подуровням
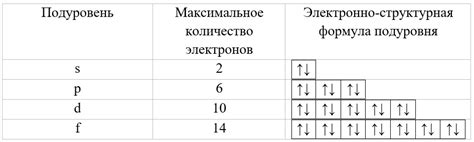
Распределение электронов по подуровням является важным аспектом в строении электронной оболочки атома металла. Подуровни - это энергетические состояния электронов внутри электронной оболочки, которые характеризуются своими квантовыми числами.
Подуровни обозначаются буквой английского алфавита, например, s, p, d, f. Первый подуровень s может содержать максимум 2 электрона, второй подуровень p - 6 электронов, третий подуровень d - 10 электронов, четвертый подуровень f - 14 электронов. Таким образом, общее число электронов на каждом подуровне зависит от его порядкового номера.
В процессе заполнения электронной оболочки металла электроны распределяются по подуровням по принципу максимальной заполненности. Сначала заполняются подуровни с наименьшими значениями энергии, и только затем переходят к более высоким энергетическим уровням.
Распределение электронов по подуровням имеет важное значение для объяснения свойств металлов, так как электронная структура атомов металлов определяет их химическую реактивность и физические свойства, такие как проводимость электричества и тепла, пластичность и многие другие.
Принцип заполнения энергетических уровней

Как известно, атом металла состоит из ядра и облака электронов, расположенных на энергетических уровнях. Процесс заполнения этих уровней регулируется принципами, которым подчиняются электроны.
Первый принцип заполнения уровней, известный как принцип Паули, гласит, что на каждом энергетическом уровне может находиться не более двух электронов с противоположными спинами. Это значит, что если на уровне уже находятся два электрона, то следующий электрон будет располагаться на следующем доступном уровне.
Второй принцип, известный как принцип Хунда, гласит, что электроны, занимающие одноэлектронные орбитали с одинаковыми энергиями, будут размещаться так, чтобы число электронов с максимальным спином было максимальным. То есть, электроны будут заполнять энергетические уровни одного подуровня в одиночные орбитали, прежде чем заполнять орбитали с парами электронов.
Принцип заполнения энергетических уровней играет важную роль в определении физических и химических свойств атомов металла. В результате строго следуя указанным принципам, электроны занимают определенные орбитали с разными энергиями, формируя структуру атома металла и определяя его свойства.
Разделение электронных подуровней
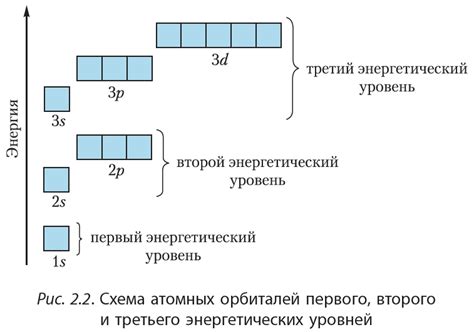
Электронные подуровни - это субуровни энергетического уровня атома, на которых размещаются электроны. На каждом энергетическом уровне может быть несколько подуровней, которые различаются формой орбитали и магнитными квантовыми числами.
Разделение электронных подуровней происходит в результате многообразия форм орбиталей, которые могут быть шаровыми (s), плоскими (p), двухлопастными (d) и десятилопастными (f). Каждый подуровень имеет свойственное ему количество орбиталей и возможное число электронов.
Например, электронный подуровень s может содержать только одну орбиталь и максимально два электрона, а подуровень p - три орбитали и максимально шесть электронов. Подуровень d имеет пять орбиталей и может содержать до десяти электронов, а подуровень f - семь орбиталей и максимально четырнадцать электронов.
Разделение электронных подуровней влияет на физические и химические свойства атома металла. Например, металлы с заполненными d-подуровнями обладают высокой теплопроводностью и электропроводностью, а также образуют сложные соединения с другими элементами.
Сетка энергетических уровней атома металла
Атом металла состоит из ядра, вокруг которого располагаются электроны на различных энергетических уровнях. Структура этих уровней образует своего рода сетку, которая определяет свойства и характеристики металла.
На самом низком энергетическом уровне атома металла располагается основное состояние – состояние, в котором находится большинство электронов. Остальные энергетические уровни называются возбужденными состояниями, и они находятся на более высоких энергетических уровнях.
Количество электронов на каждом энергетическом уровне определяется в соответствии с правилом заполнения электронных оболочек. По правилу Паули на каждом уровне могут находиться не более двух электронов с противоположными спинами. В соответствии с правилом Гунда число электронов на каждом энергетическом уровне увеличивается от 1 до максимального значения, определяемого периодической таблицей элементов.
Сетка энергетических уровней атома металла можно представить в виде таблицы, где каждый энергетический уровень представлен строкой, а количество электронов на каждом уровне – столбцом. Такая таблица позволяет наглядно визуализировать распределение электронов в атоме металла и выявить закономерности в структуре и свойствах металлических элементов.
Вопрос-ответ

Как распределяются электроны по энергетическим уровням в атоме металла?
Электроны в атоме металла распределяются по энергетическим уровням в соответствии с принципом заполнения, который гласит, что электроны заполняют уровни энергии по возрастанию.
Есть ли какие-то особенности в распределении электронов в атоме металла?
Да, есть. В атоме металла, в отличие от атомов других элементов, электроны заполняют сначала уровни s, затем p, d и f. Это происходит из-за особенностей электронной конфигурации металлов.
Какие правила можно использовать для определения электронной конфигурации атома металла?
Для определения электронной конфигурации атома металла можно использовать правило заполнения уровней энергии: s, p, d, f. Также можно применять правила Хунда и Паули, которые описывают взаимодействие электронов в атоме.
