Таблица Менделеева - это уникальная система упорядоченного представления химических элементов, изобретенная русским ученым Дмитрием Менделеевым в 1869 году. Расположение элементов в таблице основывается на их атомных номерах, электронной конфигурации и химических свойствах. Одна из важных характеристик элементов, которая определяет их положение в таблице Менделеева, является их металлический характер.
Металлы - это элементы, характеризующиеся хорошей проводимостью тепла и электричества, глянцевым блеском, пластичностью и способностью образовывать ионы положительного заряда (катионы). Они составляют основную массу элементов в таблице Менделеева и расположены слева от чередующейся линии.
Металлы в таблице Менделеева группируются в несколько блоков. Самыми распространенными металлами являются элементы из блока s и блока d. В блоке s находятся щелочные и щелочноземельные металлы, такие как литий, натрий, калий, магний, кальций и др. Эти элементы характеризуются низкой плотностью, низкой температурой плавления и высокой реакционной способностью.
Блок d включает в себя переходные металлы, такие как железо, медь, цинк, никель и др. Эти элементы отличаются высокой твердостью, высокой плотностью и способностью образовывать различные ионы положительного заряда. Они также являются хорошими проводниками тепла и электричества.
Историческая справка

Получение и использование металлов
Свойства металлов известны человечеству с древних времен. Один из самых древних металлов, которыми пользовалась человеческая цивилизация, - медь. Медь была известна в Древнем Египте и Древнем Вавилоне уже около 3000 лет до нашей эры. Она использовалась для изготовления ювелирных украшений, оружия и инструментов.
Однако, до конца XVIII века металлы были относительно редкими и дорогими материалами. С развитием техники и научных исследований было разработано множество способов производства и получения металлов. К началу XIX века было открыто много новых элементов, и на этом этапе стала возникать необходимость в упорядочении полученных данных.
В 1869 году российский химик Дмитрий Менделеев предложил систематизировать информацию о химических элементах и представить ее в виде таблицы. В такой таблице элементы размещались в порядке возрастания атомных масс, и при этом сохранялись закономерности их химических свойств.
Таблица Менделеева стала важным инструментом для изучения и понимания химических элементов. Она быстро стала популярной и получила широкое признание в научном мире. В настоящее время таблица Менделеева содержит данные о более 100 элементах, каждый из которых имеет свое расположение и атомный номер в этой таблице.
Группы элементов металлов

В таблице Менделеева металлы расположены в нескольких группах в зависимости от их химических свойств и характеристик. Эти группы образуют вертикальные столбцы в таблице и помогают классифицировать элементы.
Группа 1: В ней находятся щелочные металлы, такие как литий, натрий, калий и др. Они характеризуются низкой плотностью, низкой температурой плавления и высокой реактивностью. Они активно взаимодействуют с водой и окисляются.
Группа 2: Эта группа содержит щелочноземельные металлы, такие как магний, кальций, стронций и др. Они обладают более высокой плотностью и температурой плавления по сравнению с щелочными металлами. Щелочноземельные металлы реагируют с кислородом и образуют оксиды.
Тransition words: Далее, Кроме того, Более того
Группа 3-12: Это переходные металлы, такие как железо, медь, цинк и др. Они характеризуются высокой твердостью, плавкостью и химической активностью. Переходные металлы имеют переменное количество электронов в своих внешних оболочках, что позволяет им образовывать соединения с различными зарядами.
Группа 13: Эта группа включает элементы, такие как алюминий, галлий, индий и др. Эти элементы являются полуметаллами или содержат металлические и неметаллические свойства. Они обладают химической активностью и способны образовывать соединения с различными типами элементов.
Группа 14: В ней находятся элементы, такие как кремний, олово, свинец и др. Эти элементы обладают средней химической активностью и имеют различные применения в промышленности и технологии.
Группа 15: Это элементы, такие как азот, фосфор, магнезий и др. Они обладают химической активностью и используются в различных областях, включая сельское хозяйство и фармацевтику.
Группа 16: В ней находятся элементы, такие как кислород, сера, селен и др. Они обладают высокой химической активностью и выступают в качестве неметаллов.
Группа 17: Это галогены, такие как фтор, хлор, бром и др. Галогены обладают высокой реактивностью, электроотрицательностью и способностью образовывать химические соединения с другими элементами.
Группа 18: Эта группа содержит благородные газы, такие как гелий, неон, аргон и др. Благородные газы являются неподвижными и очень низкой реактивностью. Они используются в различных приложениях, включая освещение и заполнение газовых ламп.
Таким образом, расположение элементов металлов в группах таблицы Менделеева помогает классифицировать их по их химическим свойствам и характеристикам.
Переходные металлы

Переходные металлы - это группа элементов, которая занимает центральное положение в таблице Менделеева между щелочными металлами и неметаллами. Они имеют свойства, которые делают их уникальными и важными в различных отраслях науки и промышленности.
Переходные металлы характеризуются наличием внутренней d-оболочки, которая участвует в образовании электронной конфигурации атомов. Их атомы имеют неполно заполненную d-оболочку и могут образовывать соединения с разными степенями окисления.
Эти элементы обладают высокой термо- и химической стабильностью, что делает их применимыми в различных катализаторах, сплавах и магнитных материалах. Они также являются важными компонентами в электронике, энергетике и металлургии.
Переходные металлы могут образовывать химические соединения, которые имеют различные цвета, отличающиеся от исходных элементов. Это связано с возможностью поглощения и рассеяния света. Например, сплавы переходных металлов с другими элементами могут иметь яркий цвет, что делает их популярными материалами для ювелирных изделий и украшений.
В таблице Менделеева переходные металлы расположены в блоке d, который включает 10 групп элементов. К ним относятся металлы железа, никеля, меди, цинка, кобальта и многие другие. Они имеют различные физические и химические свойства, что позволяет им находить применение в разных отраслях промышленности и науки.
Щелочные металлы и щелочноземельные металлы
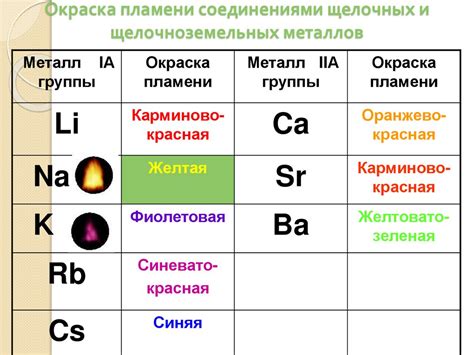
Щелочные металлы и щелочноземельные металлы - две группы элементов в таблице Менделеева, которые располагаются около друг друга, но имеют различные свойства и химическую реактивность. Щелочные металлы включают в себя литий, натрий, калий, рубидий, цезий и франций. Щелочноземельные металлы включают в себя бериллий, магний, кальций, стронций, барий и радий.
Щелочные металлы имеют один валентный электрон в своей внешней электронной оболочке и они реагируют легко с водой, кислородом и галогенами. Эти металлы обладают металлическим блеском и мягкостью, а их плавление и кипение низкие. Кроме того, щелочные металлы хорошо ведут электричество и тепло, и они широко используются в разных сферах, включая производство щелочей, батарей, сплавов и легких конструкций.
Щелочноземельные металлы также имеют свои особенности. Они обладают двумя валентными электронами в своей внешней электронной оболочке, что делает их менее реактивными, чем щелочные металлы. Щелочноземельные металлы не реагируют с водой так активно, как щелочные металлы, однако они могут быть использованы в процессе очистки воды от загрязнений. Щелочноземельные металлы также широко используются в разных областях, включая металлургию, строительство и производство сплавов и керамики.
Переходные металлы и платиновые металлы

Переходные металлы – это элементы, которые занимают центральное положение в таблице Менделеева. Они находятся между щелочными металлами и металлами побочных групп. Переходные металлы обладают характерными свойствами, такими как валентность, магнетизм и способность образовывать соединения с различными элементами.
Переходные металлы можно разделить на две группы: первую и вторую переходные серии. Первая переходная серия состоит из 10 элементов, начиная с титана и заканчивая цинком. К ним относятся такие элементы, как хром, железо, медь и никель. Вторая переходная серия начинается с иттербия и содержит 28 элементов, включая такие известные металлы, как серебро, золото и платина.
Платиновые металлы – это особая группа переходных металлов, которые обладают высокой устойчивостью к окислительным воздействиям и коррозии. К ним относятся платина, иридий, палладий, родий, рутений и осмий. Платиновые металлы обладают высокой термической и электрической проводимостью, а также высокой плотностью и точками плавления.
Платиновые металлы имеют широкое применение в промышленности и науке. Их используют для производства ювелирных изделий, электронных компонентов, катализаторов, зеркал телескопов и многих других приборов. Благодаря своим уникальным свойствам, платиновые металлы являются важными материалами в различных отраслях промышленности и научных исследованиях.
Легкоплавкие и тяжелые металлы

Легкоплавкие металлы - это металлы, которые при повышении температуры быстро плавятся и легко меняют свою физическую форму из твердого состояния в жидкое. К таким металлам относятся, например, ртуть, олово, свинец. Ртуть при комнатной температуре находится в жидком состоянии и не имеет точки плавления.
Тяжелые металлы - это металлы, которые обладают высокой плотностью и крупнозернистой структурой. Они обычно имеют высокую температуру плавления и кипения, а также высокую тяготу кислорода и других химических элементов. К таким металлам относятся, например, свинец, ртуть, железо, полоний.
Легкоплавкие металлы часто используются в различных отраслях промышленности, таких как производство электрических проводов, пайка и припойка электронных компонентов, изготовление литейных форм для литья металла. Тяжелые металлы также имеют широкое применение в промышленности, например, железо используется в строительстве и машиностроении, свинец используется в производстве аккумуляторов и покрытий, полоний используется в ядерной промышленности.
Сверхтяжелые металлы

Сверхтяжелые металлы - это элементы, которые находятся в таблице Менделеева после унунтрия и обладают атомными номерами выше 103. Основными представителями сверхтяжелых металлов являются радиоактивные элементы, которые получены искусственным путем в ядерных реакторах или акселераторах.
Сверхтяжелые металлы обладают высокой плотностью и являются самыми тяжелыми элементами, известными человечеству. Они отличаются сложной электронной структурой и имеют нестабильные атомы, которые распадаются со временем. Поэтому сверхтяжелые металлы исследуются исключительно в научных целях и не имеют практического применения в технологических процессах.
Самым известным сверхтяжелым металлом является унунпентий (элемент с атомным номером 115), который был впервые синтезирован российскими и американскими учеными в 2003 году. Другими представителями сверхтяжелых металлов являются унуноктий (элемент с атомным номером 118) и унунтрий (элемент с атомным номером 113).
Исследование сверхтяжелых металлов имеет важное значение для фундаментальной науки и ядерной физики. Они позволяют углубить наше понимание структуры атомного ядра и изучить новые свойства вещества в экстремальных условиях. Также сверхтяжелые металлы могут быть использованы в различных научных исследованиях, например, в ядерных реакторах.
Взаимодействие металлов с другими элементами

Металлы представляют собой группу элементов, характеризующихся высокой электропроводностью, металлическим блеском и способностью образовывать положительные ионы. Свойства металлов делают их особенно важными во многих сферах промышленности и повседневной жизни.
Взаимодействие металлов с другими элементами может происходить по разным механизмам. Одним из наиболее распространенных способов является химическая реакция металлов с кислородом. Некоторые металлы, такие как железо, реагируют с кислородом воздуха, образуя окислы. Этот процесс называется окислением и является причиной коррозии металлов.
Еще одним важным видом взаимодействия металлов является их реакция с кислотами. Некоторые металлы, такие как цинк и алюминий, реагируют с кислотой, выделяя водород. Эти реакции широко используются в промышленности, например, для производства водорода или в качестве источника энергии в гальванических элементах.
Металлы также могут образовывать соединения с другими металлами. Это так называемые сплавы, которые обладают уникальными свойствами и широко используются в производстве различных материалов. Например, сплавы алюминия с различными металлами используются для изготовления легких и прочных конструкций, а сплавы меди с цинком — для производства латуни.
Кроме того, металлы могут образовывать соединения с неметаллическими элементами, такими как сера, хлор или кислород. Например, железо может образовывать соединения с серой, образуя так называемые сульфиды. Эти соединения можно встретить как природные руды, а также использовать в различных отраслях промышленности.
Вопрос-ответ

Зачем нужна таблица Менделеева?
Таблица Менделеева является основным инструментом организации информации о химических элементах. Она позволяет систематизировать элементы по их атомным номерам, химическим свойствам и физическим характеристикам. Также таблица Менделеева помогает предсказывать свойства новых элементов и создавать различные химические соединения.
Как расположены элементы металлов в таблице Менделеева?
Элементы металлов в таблице Менделеева расположены слева от линии, разделяющей металлы и неметаллы. Они занимают большую часть таблицы и включают такие элементы, как литий, натрий, калий, железо, медь и многое другое. Металлы обладают характерными свойствами, такими как хорошая проводимость электричества и тепла, гибкость и прочность.
Какие элементы металлов наиболее распространены в природе?
Наиболее распространенными элементами металлов в природе являются кислород, кремний, алюминий, железо, кальций, натрий, калий и магний. Они встречаются в различных минералах, рудах и почве. Кроме того, сплавы металлов, такие как бронза и сталь, широко используются в промышленности и строительстве.
