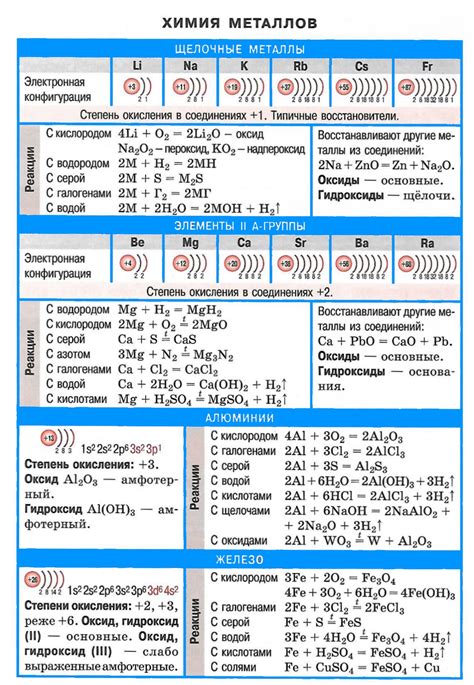
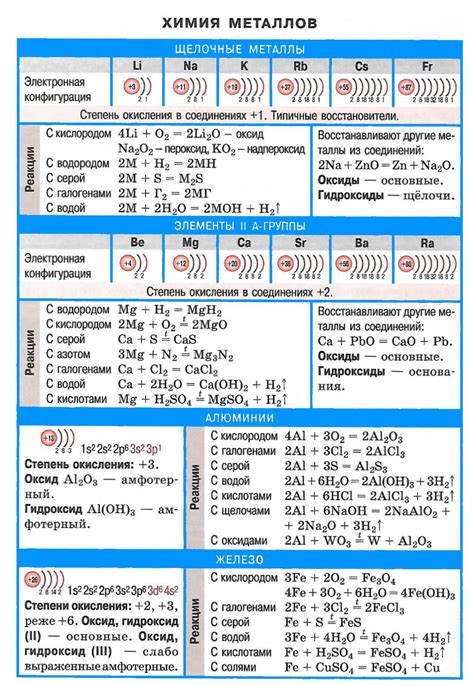
Щелочные металлы – это группа элементов периодической системы, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к первой группе элементов с атомным номером от 3 до 11, и характеризуются высокой реакционностью, низкой плотностью и низкой температурой плавления. Щелочные металлы являются важными для многих областей науки и технологии, включая электрохимию, биохимию, физику и материаловедение.
Расчетные задачи по теме щелочные металлы позволяют углубить знания о физических свойствах и химической реактивности этих элементов. В ходе таких задач может потребоваться рассчитать массовую долю щелочного металла в соединении, определить количество осадков, образующихся при химической реакции, или решить задачу об электрохимическом потенциале клетки с участием щелочных металлов. Для решения таких задач необходимо использовать основные понятия химии, такие как моль, молярная масса, стехиометрический коэффициент, электрохимический эквивалент и другие.
Методы решения расчетных задач по теме щелочные металлы основаны на применении законов химии, таких как закон сохранения массы, закон пропорций, закон Гесса и закон фарадея. Для получения точных результатов необходимо учесть все условия задачи и использовать соответствующие формулы, уравнения и константы. Также для упрощения решения можно использовать аппроксимации и приближенные методы, основанные на опытных данных и эмпирических законах.
Расчетные задачи по теме щелочные металлы представляют собой интересную и актуальную задачу для студентов и специалистов в области химии и материаловедения. Решение таких задач позволяет лучше понять физико-химические процессы, происходящие с щелочными металлами, и применить полученные знания на практике в решении различных научных и инженерных задач.
Понятие и свойства щелочных металлов

Щелочные металлы - это группа элементов, которая включает в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они находятся в первой группе периодической системы и имеют химические свойства, общие для данной группы.
Основные свойства щелочных металлов:
- Щелочные металлы являются очень реактивными и хорошо растворимыми в воде. Реакция щелочных металлов с водой приводит к выделению водорода и образованию щелочных гидроксидов (гидроксиды лития, натрия, калия, рубидия и цезия имеют формулу LiOH, NaOH, KOH, RbOH и CsOH соответственно).
- Щелочные металлы имеют низкую плотность и низкую температуру плавления. Например, литий имеет плотность всего 0,53 г/см³, а его температура плавления составляет 180 °C.
- Щелочные металлы обладают высокой электропроводностью. Их металлические свойства делают их идеальными материалами для использования в аккумуляторах и других электронных устройствах.
- Щелочные металлы катионы, образуемые этими элементами в процессе ионизации, имеют единичную зарядность. Натрий, калий и другие щелочные металлы образуют стабильные соединения с отрицательными анионами, такими как хлориды, сульфаты и нитраты.
Из-за своей высокой реактивности, щелочные металлы активно взаимодействуют с другими элементами, образуя различные соединения. Они широко используются в промышленности и научных исследованиях. Знание свойств щелочных металлов очень важно для понимания их взаимодействия с другими веществами и их применения в различных отраслях науки и техники.
Атомная структура и химические свойства
Атомная структура — это описание внутреннего строения атома, его составных частей и их взаимодействия. Атом состоит из ядра, в котором находятся протоны и нейтроны, и электронной оболочки, на которой располагаются электроны.
Число протонов в атоме называется порядковым числом и определяет его атомный номер. Число нейтронов и электронов может варьировать, создавая различные изотопы и ионы.
Химические свойства атомов определяются их атомными ионизационными потенциалами, аффинностью к электрону и электроотрицательностью. Через химические свойства атомов определяются связи между ними и возможность образования химических соединений.
Атомы щелочных металлов, таких как литий, натрий, калий, рубидий и цезий, обладают выраженной восприимчивостью к окислению и образуют положительные ионы. Их электроотрицательность невысока, что позволяет им образовывать простые соединения с другими элементами.
Взаимодействие атомов щелочных металлов с водой приводит к взрывоопасным реакциям, так как образуются щелочные гидроксиды и высвобождается водород. Это свойство щелочных металлов находит широкое применение в различных сферах, от промышленности до медицины.
Атомная структура и химические свойства щелочных металлов являются основой для понимания их реакционной способности и возможности использования в различных процессах и технологиях.
Реакции щелочных металлов с веществами
Реакции щелочных металлов с веществами являются одним из основных разделов изучения химии. Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают высокой активностью и легко вступают в химические реакции с различными веществами.
При взаимодействии щелочных металлов с водой происходит образование гидроксидов щелочных металлов и выделение водорода. Реакция протекает с выделением тепла и может быть очень интенсивной, особенно при реакции с калием и натрием.
Щелочные металлы также реагируют с кислотами, образуя соли и выделяя водород. Реакция щелочных металлов с кислотами происходит с большим выделением тепла и может протекать крайне быстро.
Одной из важных реакций щелочных металлов является их взаимодействие с кислородом. В результате образуются оксиды щелочных металлов. Например, литий при взаимодействии с кислородом образует оксид лития, который хорошо растворяется в воде.
- Щелочные металлы также реагируют с галогенами, образуя галогениды щелочных металлов. Например, натрий вступает в реакцию с хлором, образуя хлорид натрия.
- Взаимодействие щелочных металлов с аммиачными соединениями также протекает с образованием соответствующих солей.
Реакции щелочных металлов с веществами являются основой для понимания химических свойств их соединений. Они широко используются в различных областях науки и промышленности, таких как производство щелочей, батареек, сплавов и других химических продуктов.
Расчетные задачи по расчетам массы и количеству вещества

Решение расчетных задач, связанных с определением массы и количества вещества, является важной частью изучения щелочных металлов. Для расчетов используются основные понятия, такие как молярная масса, массовая доля и количество вещества.
Для решения задач по расчету массы вещества необходимо знать молярную массу данного вещества. Молярная масса - это масса одного моля вещества и выражается в граммах на моль. Чтобы найти массу вещества, используется формула: масса = количество вещества * молярная масса.
Для расчетов массовой доли вещества в смеси необходимо знать массу данного вещества и общую массу смеси. Массовая доля - это отношение массы данного вещества к общей массе смеси, выраженное в процентах. Формула для расчета массовой доли: массовая доля = (масса вещества / общая масса смеси) * 100%.
Количество вещества - это физическая величина, характеризующая количество молекул, атомов или ионов вещества. Для расчетов количества вещества используется формула: количество вещества = масса вещества / молярная масса. Количество вещества обычно выражается в молях.
Решение расчетных задач по расчетам массы и количеству вещества требует точных расчетов и использования основных понятий и формул. Обратите внимание на единицы измерения и правильное применение формул для получения верных результатов.
Методы решения расчетных задач

При решении расчетных задач по теме щелочные металлы необходимо применять определенные методы, которые позволяют решить задачу более эффективно и точно.
Один из таких методов – метод перевода массы вещества из одной системы единиц в другую. Для этого используются соотношения между массой и числом молей вещества, а также между массой и объемом газа.
Еще одним методом решения задач является метод использования молярной массы. При его применении необходимо знать состав вещества и его молярную массу. С помощью этого метода можно рассчитать массу или объем вещества, а также произвести комплексные расчеты, связанные с взаимодействием различных веществ.
Также для решения расчетных задач по щелочным металлам можно использовать метод стехиометрических соотношений. Этот метод позволяет определить количество вещества, необходимое для реакции или образования определенного продукта. Для этого необходимо знать стехиометрическое соотношение между веществами и их молярную массу.
Помимо указанных методов, при решении расчетных задач возможно применение других методов, например, метода энергетического баланса или метода конечных разностей. Важно выбрать наиболее подходящий метод для каждой конкретной задачи и умело его применить для получения точного результата.
Примеры расчетных задач по теме щелочные металлы
Для определения концентрации калия в образце необходимо провести растворение образца в кислоте, а затем выполнить титрование полученного раствора раствором стандартного щелочного раствора. Найдите концентрацию калия в образце, если при титровании использовано 20 мл щелочного раствора с концентрацией 0.1 М и было использовано 25 мг образца.
Рассчитайте массу натрия, необходимую для приготовления 200 мл раствора с концентрацией 0.5 М. Для решения задачи используйте уравнение реакции между натрием и водой, а также вычислите молярную массу натрия.
Определите массу калия, которую нужно добавить в 500 мл воды для приготовления раствора с концентрацией 0.1 М. Для решения задачи используйте молекулярную массу калия и уравнение реакции между калием и водой.
Рассчитайте массу лития, содержащуюся в 100 мл водного раствора с концентрацией 0.05 М. Для решения задачи используйте уравнение реакции между литием и водой, а также вычислите молярную массу лития.
Оцените объем щелочного раствора с концентрацией 0.5 М, который необходим для полного растворения 10 г калия. Для решения задачи используйте уравнение реакции между калием и водой, а также вычислите мольное число воды.
Вопрос-ответ

Что такое щелочные металлы?
Щелочные металлы – это группа химических элементов, включающая литий, натрий, калий, рубидий, цезий и франций. Они относятся к первой группе периодической системы и обладают общими химическими свойствами, такими как низкая плотность, низкая температура плавления и реактивность с водой.
Какие основные методы решения расчетных задач по щелочным металлам существуют?
Для решения расчетных задач по щелочным металлам применяются различные методы, включая расчеты по законам сохранения массы и энергии, использование физических и химических свойств этих элементов, а также применение уравнений состояния и стехиометрических соотношений.
