Расчет молярной массы эквивалента металла при соединении с хлором является важным этапом в изучении химических реакций и определении количества вещества, которое будет вступать в реакцию с хлором. Молярная масса эквивалента металла представляет собой массу металла, эквивалентную одному эквиваленту.
Эквивалент металла определяется через количество электронов, которые металл способен отдать или принять в реакции. При соединении металла с хлором, металл обычно отдает электроны, образуя положительно заряженный ион, а хлор принимает электроны, образуя отрицательно заряженный ион. Таким образом, эквивалент металла соответствует количеству электронов, способных быть отданными или принятыми металлом.
Молярная масса эквивалента металла рассчитывается путем деления молярной массы металла на количество электронов, отданных или принятых им в реакции. Этот показатель позволяет определить, сколько металла требуется для проведения реакции с определенным количеством хлора. Расчет молярной массы эквивалента металла позволяет также установить соотношение между массой металла и массой хлора в реакции и определить стехиометрические соотношения между реагентами.
Понятие молярной массы

Молярная масса - это физическая величина, определяющая массу одного моля вещества. Она выражается в г/моль. Молярная масса является ключевым понятием в химии, так как она позволяет производить не только преобразование массы вещества в количество вещества, но и обратное преобразование.
Молярная масса рассчитывается путем сложения атомных масс всех атомов, составляющих молекулу вещества. Атомные массы обычно указываются в атомных единицах массы (аму), где 1 аму равно 1/12 массы атома углерода-12. Например, молярная масса воды (H2O) равна сумме атомных масс двух атомов водорода и одного атома кислорода.
Молярная масса позволяет проводить различные расчеты химических реакций, такие как расчет количества вещества, полученного или потребляемого в реакции. Она также необходима для определения стехиометрических соотношений между различными реагентами и продуктами реакции.
Молярная масса играет важную роль в расчетах в химической промышленности, аналитической химии и физической химии. Она также позволяет определять плотность вещества, молярный объем и другие физические и химические свойства.
Определение и основные принципы
Расчет молярной массы эквивалента металла при соединении с хлором является важной задачей в химии. Молярная масса эквивалента металла определяет количество вещества этого металла, которое при соединении с хлором образует один эквивалентное количество хлорида металла.
Для проведения расчета молярной массы эквивалента металла с хлором, необходимо знать молекулярную массу металла и соотношение его атомов в хлориде. Молярная масса эквивалента металла рассчитывается по формуле: молярная масса эквивалента металла = молярная масса хлорида металла / количество атомов металла в хлориде.
Основные принципы расчета молярной массы эквивалента металла включают определение молекулярной массы хлорида металла, которая рассчитывается как сумма масс атомов металла и хлора, умноженных на их количество в молекуле. Затем необходимо определить количество атомов металла в хлориде и использовать его для расчета молярной массы эквивалента металла.
Металлы и хлор
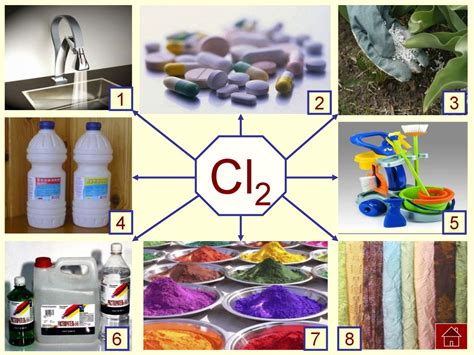
Металлы и хлор - это соединение, которое активно изучается в химической науке. Хлор является одним из самых распространенных химических элементов, а металлы, в свою очередь, образуют большую группу химических веществ.
Хлор обладает высокой реакционной способностью и имеет способность соединяться с различными металлами. При соединении с металлами образуются соли, которые имеют различные свойства и применения.
Металлы могут вступать в реакцию с хлором как в твердом, так и в жидком состоянии. Образуется множество различных хлоридов, включая хлориды щелочных металлов, щелочноземельных металлов, переходных металлов и других элементов.
Один из важных аспектов изучения реакции металлов с хлором заключается в определении молярной массы эквивалента металла. Эта величина определяет количество металла, которое реагирует с одним молью хлора. Расчет молярной массы эквивалента металла имеет большое значение как в теоретических, так и в практических аспектах химических исследований.
Изучение свойств и реакций металлов с хлором является важным этапом в химическом анализе и синтезе различных веществ. Это позволяет узнать о возможностях реакции металлов с хлором и применить их в различных областях, таких как промышленность, медицина и электроника.
Свойства и реакции
Металлы – это группа химических элементов, обладающих рядом характерных свойств. Они отличаются высокой тепло- и электропроводностью, блеском поверхности, способностью образовывать ионы положительного заряда.
Металлы активно взаимодействуют с другими веществами, включая хлор. Когда металл соединяется с хлором, происходит химическая реакция, в результате которой образуется металлический хлорид. Эта реакция может происходить как в газообразной, так и в жидкой или твердой фазе.
Реактивность металлов в реакциях с хлором зависит от их положения в ряду активности металлов. Наиболее реакционными являются щелочные металлы, такие как натрий и калий, которые мгновенно реагируют с хлором, образуя хлориды этих металлов. Менее реакционные металлы, такие как железо, реагируют медленнее и требуют высоких температур для начала реакции.
Например, реакция меди с хлором происходит при нагревании:
- Вещества взаимодействуют, образуя медный хлорид:
- Cu + Cl2 → CuCl2
- 2 CuCl2 + 2 H2O → CuCl2 · 2H2O
Таким образом, при соединении металла с хлором образуется металлический хлорид, который может иметь важное применение в различных областях, включая химическую промышленность и лабораторные исследования.
Молярная масса металла

Молярная масса металла является важным характеристикой, которая позволяет определить массу одного моля вещества. Расчет молярной массы металла основан на сумме атомных масс его элементов.
Для проведения расчета необходимо учесть все атомы металла, а также их относительные молекулярные массы. Затем эти значения суммируются и полученная сумма является молярной массой металла.
Молярная масса металла имеет большое значение при проведении химических расчетов, так как она позволяет определить количество вещества на основе его массы. Это позволяет точно производить дозировку и смешивание различных реактивов.
Кроме того, молярная масса металла может быть использована для определения прочности и структуры металла. Зная молярную массу, можно расчитывать количество атомов в определенном объеме металла и анализировать его свойства и особенности.
Методы определения

Существуют различные методы определения молярной массы эквивалента металла при соединении с хлором, которые основываются на различных принципах и применяются в разных областях науки и промышленности.
Один из наиболее распространенных методов - гравиметрический метод. В этом методе осуществляется взвешивание смеси образца металла и хлорида металла до и после процесса реакции. Разность массы с помощью соответствующих расчетов позволяет определить молярную массу эквивалента металла.
Другой метод - титриметрический, который основан на определении концентрации раствора хлорида металла с использованием вещества, способного реагировать с хлоридами. Путем титрования раствора хлорида металла с известным объемом титранта можно определить молярную массу эквивалента металла.
Также существует спектроскопический метод, который основан на измерении поглощения или испускания электромагнитного излучения веществом. Применяя спектральный анализ, можно определить концентрацию и состав хлорида металла, а затем рассчитать молярную массу эквивалента металла.
Исследователи также используют электрохимический метод, который основывается на измерении электрических параметров реакции между металлом и хлором. Анализируя изменения напряжения и тока в процессе реакции, можно определить молярную массу эквивалентов металла и хлора.
Каждый из перечисленных методов имеет свои преимущества и ограничения, и выбор метода зависит от условий эксперимента и целей исследования. Важно правильно провести эксперименты и использовать соответствующие методы для получения надежных результатов при определении молярной массы эквивалента металла при соединении с хлором.
Молярная масса хлора
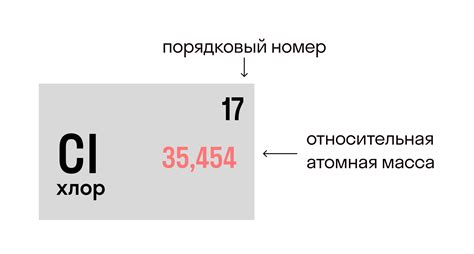
Молярная масса хлора – это величина, которая определяется суммарной массой атомов хлора в одном моле вещества. Она является физической характеристикой элемента и используется в химических расчетах.
Масса одного моля хлора составляет примерно 35,45 грамма. Это значение устанавливается исходя из среднего атомного веса хлора, который равен примерно 35,45 г/моль. Молярная масса хлора позволяет рассчитывать количество вещества на основе его массы и наоборот.
Например, если дано количество хлора в граммах, его можно перевести в количество вещества в молях, разделив массу на молярную массу. Также, зная количество вещества хлора в молях, можно рассчитать его массу, умножив количество вещества на молярную массу.
Молярная масса хлора играет важную роль при расчете массы соединений, в которых содержится хлор. Например, для расчета молярной массы хлорида натрия (NaCl) нужно сложить массу натрия (Na) и массу хлора (Cl). Это позволяет определить количество вещества в соединении и провести необходимые химические расчеты.
Методы расчета
Существуют различные методы расчета молярной массы эквивалента металла при соединении с хлором. Один из таких методов основан на использовании уравнения реакции.
Сначала необходимо записать и сбалансировать уравнение реакции между металлом и хлором. Затем находим количество вещества каждого реагента, используя данные о массе и молярной массе. Далее, с помощью коэффициентов реакции, определяем соотношение между молями металла и хлора, а затем находим молярную массу эквивалента металла.
Другой метод включает использование физических свойств реагентов и продуктов реакции. Разделяя массу хлора на его объем, можно найти плотность газа. Затем, используя объем газа и его молярную массу, можно найти моль хлора. Таким образом, измеряя массу и объем металла и хлора, можно найти их молярное соотношение и молярную массу эквивалента металла.
Еще одним методом является использование данных об ионном заряде металла и анализа реакции. Известные значения заряда металла и его плотности позволяют вычислить количество вещества металла. Далее, с использованием данных о массе хлора и его молярной массе, можно найти моль хлора. Из соотношения молей металла и хлора можно найти молярную массу эквивалента металла.
Вопрос-ответ

Как расчитать молярную массу эквивалента металла при соединении с хлором?
Для расчета молярной массы эквивалента металла при соединении с хлором необходимо знать молярную массу металла и его стехиометрическое соотношение с хлором. Молярная масса эквивалента металла вычисляется путем деления молярной массы металла на его стехиометрический коэффициент в реакции с хлором.
Как определить молярную массу металла, если известна его масса и количество вещества?
Для определения молярной массы металла по его массе и количеству вещества необходимо воспользоваться формулой: молярная масса = масса / количество вещества. При этом необходимо обратить внимание на то, что масса должна быть выражена в граммах, а количество вещества в молях.
Как узнать стехиометрическое соотношение металла и хлора в реакции?
Стехиометрическое соотношение металла и хлора в реакции можно узнать путем анализа уравнения реакции между металлом и хлором. Стехиометрический коэффициент перед соединением металла в уравнении показывает соотношение между металлом и хлором. Например, если уравнение реакции выглядит как: М + Cl2 → МCl2, то соотношение металла и хлора равно 1:1.
Какие данные необходимы для расчета молярной массы эквивалента металла при соединении с хлором?
Для расчета молярной массы эквивалента металла при соединении с хлором необходимо знать молярную массу самого металла, его стехиометрическое соотношение с хлором (которое можно узнать из уравнения реакции) и знать количество вещества металла, участвующего в реакции.
