Электролиз – это процесс, при котором путем применения электрического тока происходит превращение химических веществ. Одним из видов электролиза является электролиз металлов. Этот процесс часто применяется в промышленности для получения различных металлических изделий.
Расчет массы металла, получаемого в результате электролиза, является важной задачей для научных исследований и технической практики. Для рассчета необходимо учитывать несколько факторов, таких как сила тока, время электролиза и молярная масса металла.
Сначала необходимо определить количество перенесенного электричества, которое можно вычислить по формуле: количество заряда равно произведению силы тока на время электролиза. Далее необходимо выразить это количество заряда через количество молей электролизированного вещества, используя число Авогадро.
Когда известно количество молей металла, можно рассчитать массу металла по формуле: масса равна произведению количества молей на молярную массу металла. Таким образом, с помощью этих формул можно точно рассчитать массу металла, получаемого при электролизе.
Что такое электролиз?
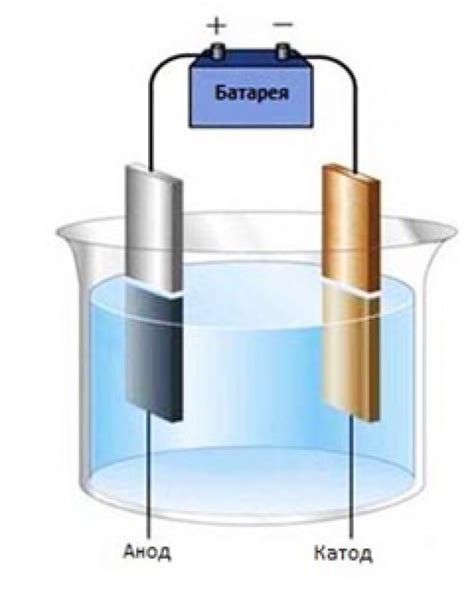
Электролиз - это процесс разложения вещества под воздействием электрического тока. Он основан на использовании электролитических ячеек, в которых происходит электролитическая окислительно-восстановительная реакция.
В электролизе применяется специальный аппарат - электролизер, в котором размещаются два электрода - анод и катод. Анод - это положительно заряженный электрод, на котором происходит окисление вещества. Катод - это отрицательно заряженный электрод, на котором происходит восстановление вещества. Между анодом и катодом пролегает электрический ток, который позволяет происходить окислительно-восстановительным реакциям.
Во время электролиза происходит разложение электролита на ионы, которые перемещаются к электродам в зависимости от заряда. Ионы, несущие положительный заряд, перемещаются к катоду, где восстанавливаются и образуют осадок или газ. Ионы, несущие отрицательный заряд, перемещаются к аноду, где окисляются и образуют продукты реакции.
Электролиз широко применяется в промышленности для получения металлов и других веществ, а также в лабораторной практике для проведения различных химических экспериментов. Он играет важную роль в процессе получения и очистки различных продуктов.
Как работает электролиз?
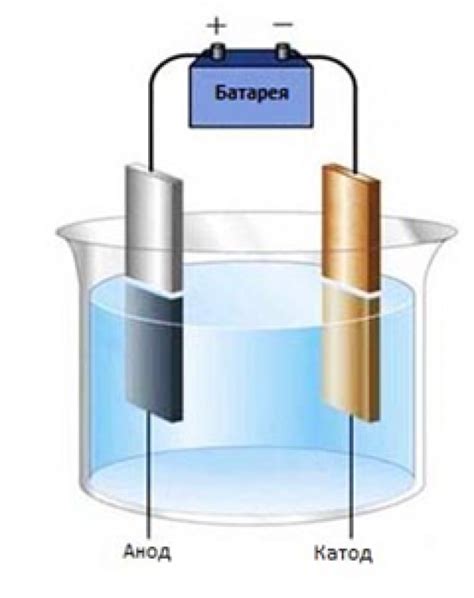
Электролиз – это процесс, при котором происходит расщепление химических соединений под воздействием электрического тока. Он основан на использовании электролитических ячеек, в которых располагаются анод и катод – электроды, через которые пропускается электрический ток.
При проведении электролиза в водных растворах металлов также используется растворитель – электролит. Электролитическая ячейка состоит из бака, в котором находится раствор металла, и двух электродов – анода и катода, которые погружены в раствор.
Под воздействием электрического тока на аноде происходит окисление, а на катоде – восстановление. Когда на аноде происходит окисление атомов металла, они переходят в ионы металла и растворяются в растворе.
На катоде же происходит обратный процесс – ионы металла принимают электроны и восстанавливаются до атомов металла, которые откладываются на поверхности катода. Таким образом, происходит отделение металла на катоде и его растворение на аноде.
Масса металла, которая откладывается на катоде в результате электролиза, зависит от силы тока, времени проведения процесса и молекулярной массы металла.
Как расчитать массу металла?

Расчет массы металла при электролизе осуществляется на основе закона Фарадея, который устанавливает пропорциональность между количеством перенесенного заряда и количеством осажденного металла при электролизе. Для проведения расчетов необходимо учитывать физические и химические параметры системы, такие как молярная масса металла, заряд электрона, время электролиза и электрический ток.
Для расчета массы металла можно использовать следующую формулу:
Масса металла = (молярная масса металла * перенесенный заряд) / (заряд электрона)
Перенесенный заряд можно определить, зная время электролиза и электрический ток:
Перенесенный заряд = электрический ток * время электролиза
Полученное значение перенесенного заряда подставляется в формулу для расчета массы металла. Молярную массу металла можно найти в химических справочниках или использовать известные значения. Заряд электрона составляет около 1.6 * 10^-19 Кл.
Также можно использовать таблицу стандартных потенциалов электродов и электрохимические эквиваленты металлов для более точных расчетов массы металла при электролизе.
Формула для расчета массы металла
При электролизе металла масса металла, образующегося на электролите, зависит от ряда факторов, таких как время проведения электролиза, сила электрического тока, концентрация раствора и молярная масса металла.
Для расчета массы металла можно использовать следующую формулу:
m = I * t * M / (n * F)
Где:
- m - масса металла, образующегося при электролизе
- I - сила электрического тока, протекающего через раствор
- t - время проведения электролиза
- M - молярная масса металла
- n - количество электронов, переданных во время электролиза
- F - постоянная Фарадея (96485 Кл/моль)
Формула позволяет определить массу металла, которая образуется на электроде при заданном времени и силе тока. Учтите, что эта формула действительна только для металлических соединений и не учитывает другие факторы, такие как эффективность электролиза и потери металла при выделении.
Важно отметить, что при проведении электролиза необходимо соблюдать все условия и предосторожности, такие как использование подходящего электрода и контроль силы тока, чтобы избежать негативных последствий и получить точные результаты.
Пример расчета массы металла
Расчет массы металла при электролизе является важным шагом для определения количества вещества, которое можно получить в ходе данной реакции. Процесс электролиза основан на применении электрического тока для разложения химических соединений на ионы в растворе.
Для расчета массы металла необходимо знать концентрацию ионов металла в растворе, а также время, в течение которого происходит электролиз. Сначала нужно определить количество электричества, проходящего через раствор, используя уравнение Q = I * t, где Q - количество электричества, I - ток в амперах, t - время в секундах.
Затем необходимо найти количество заряженных ионов, разложенных в результате электролиза, используя соотношение между зарядом и количеством вещества: n = Q / F, где n - количество электролитически разложенного вещества в молях, Q - количество электричества в кулонах, F - фарадаи.
Далее, с использованием уравнения протекающей реакции, можно определить массу металла, связанную с количеством вещества n. Например, если реакция имеет вид 2 M+ + 2e- → M, где M+ - ион металла, то масса металла будет равна M = n * Mm, где Mm - молярная масса металла.
Таким образом, расчет массы металла при электролизе является важным шагом в процессе определения выхода реакции и позволяет контролировать количество получаемого продукта. Результаты расчета могут быть использованы для оптимизации и улучшения технологии производства металлов.
Вопрос-ответ

Каким образом можно определить массу металла при электролизе?
Определить массу металла, полученного при электролизе, можно с помощью формулы Фарадея.
Какая формула поможет рассчитать массу металла при электролизе?
Для расчета массы металла при электролизе используется формула: масса металла = (молекулярная масса металла * заряд электрона * время электролиза) / (заряд металла * количество электронов в молекуле металла).
Какие данные нужно знать для расчета массы металла при электролизе?
Для расчета массы металла при электролизе необходимо знать молекулярную массу металла, заряд электрона, время электролиза, заряд металла и количество электронов в молекуле металла.
