Радиус иона металла - это один из важных характеристик, определяющих свойства металлов и их соединений. Радиус иона зависит от атомного радиуса иона, а также от его заряда. Определение радиуса иона является важным для понимания строения и свойств металлических соединений.
Радиус иона металла может быть положительным (катионом) или отрицательным (анионом), в зависимости от того, какие электроны были добавлены или удалены из атома металла. Положительные ионы металлов имеют меньший радиус по сравнению с соответствующими атомами, так как они потеряли один или несколько электронов и произошло увеличение электростатического отталкивания.
Значение радиуса ионов металлов в значительной степени зависит от их положения в таблице Менделеева. Проанализировав различные источники информации, можно составить таблицу радиусов ионов металлов и заметить некоторые особенности. Например, радиус ионов металлов обычно увеличивается с увеличением заряда ионов. Кроме того, наблюдается систематическое уменьшение радиуса ионов по горизонтали в периоде и увеличение по вертикали в группе.
Что такое радиусы ионов металлов
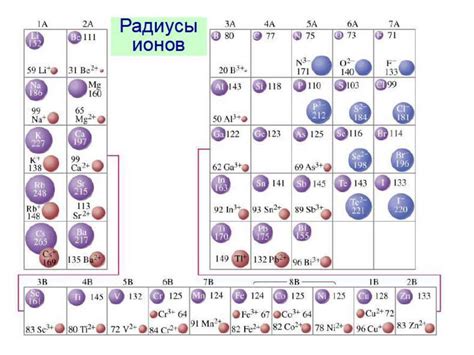
Радиус иона - это расстояние от центра иона до его величины. Он является важным параметром, определяющим свойства ионов и веществ, в которых они встречаются. Радиус иона металла может быть разным в зависимости от его валентности и физико-химических свойств.
Радиусы ионов металлов могут варьироваться в широком диапазоне в зависимости от различных факторов, включая тип металла, его заряд, валентность и структурные особенности кристаллической решетки. Величина радиуса иона металла также может распределена неоднородно внутри вещества, что дает возможность для образования различных структур и свойств.
Радиусы ионов металлов обычно измеряют в пикометрах (1 пикометр = 10^-12 метров). Они могут быть представлены в виде таблицы, в которой перечисляются различные металлы и их соответствующие радиусы ионов. Такая таблица позволяет сравнивать размеры ионов металлов и анализировать их влияние на химические и физические свойства вещества.
Радиусы ионов металлов имеют тесную связь с их положением в периодической таблице элементов. Например, радиусы ионов металлов обычно увеличиваются по мере движения слева направо вдоль периода и уменьшаются с увеличением номера группы. Это связано с изменением электронной структуры и эффективности экранирования электронов внутренними оболочками.
Радиусы ионов металлов играют важную роль в химических реакциях и реакциях обмена ионами. Они определяют взаимодействие металлов с другими веществами, а также их растворимость и способность образовывать соединения. Понимание и учет радиусов ионов металлов является ключевым фактором при изучении их свойств и использовании в различных областях науки и технологий.
Радиус иона: определение и значение
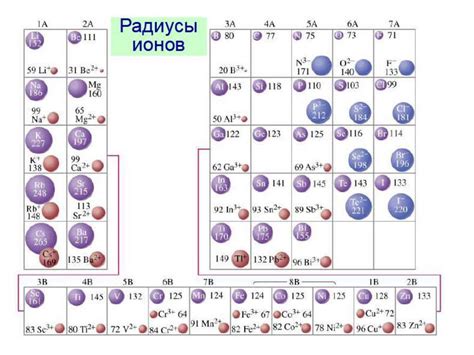
Радиус иона - это характеристика, описывающая размер иона, то есть заряженной частицы атома. Радиус иона зависит от заряда иона и его электронной конфигурации.
Значение радиуса иона важно при изучении химических свойств ионов металлов. От радиуса иона могут зависеть такие характеристики, как растворимость веществ, скорость химических реакций и способность образовывать соединения.
Радиус иона обычно выражается в пикометрах (1 пикометр равен 0,000000001 метра) и определяется с помощью различных экспериментальных методов, таких как рентгеноструктурный анализ и измерения с помощью атомно-силового микроскопа.
Значение радиуса иона может быть разным для разных ионов металлов. Например, радиус иона катиона обычно меньше радиуса иона аниона. Это связано с тем, что катионы обычно имеют меньшее количество электронов, чем анионы, и, следовательно, их размер меньше.
Также важно отметить, что радиус иона может изменяться в зависимости от окружающей среды, в которой находится ион. Например, в растворе или в кристаллической решетке величина радиуса иона может отличаться от радиуса иона в свободном состоянии.
Таблица радиусов ионов металлов

Радиус иона – один из основных характеристик металла, определяющий его химические свойства и способность вступать в реакции с другими веществами. Радиус иона зависит от его заряда и электронной конфигурации.
Для сравнения радиусов ионов металлов удобно использовать таблицу с данными, в которой указаны ионы металлов со всеми их возможными зарядами и соответствующими радиусами. В такой таблице можно увидеть закономерности и тренды в изменении радиусов ионов в периодической системе.
Например, при движении по периоду радиус ионов металлов обычно уменьшается, так как внешние электроны находятся на более удаленных от ядра энергетических уровнях. При этом, с увеличением заряда иона его радиус сокращается, так как лишние электроны притягиваются к ядру сильнее и внешние электроны находятся ближе к ядру.
В таблице радиусов ионов металлов можно видеть общие тенденции, но также есть и исключения. Например, ионы переходных металлов могут иметь несколько возможных зарядов и, соответственно, разные радиусы.
Таблица радиусов ионов металлов позволяет более наглядно представить химические свойства металлов и различия между ионами разных металлов, что особенно важно при изучении химии и химических реакций.
Особенности радиусов ионов металлов

Радиус иона — это расстояние от ядра иона до его наиболее удаленного электрона. Радиус ионов металлов имеет свои особенности, которые определяются их электронной структурой и химическими свойствами.
1. Размеры ионов металлов
Радиусы ионов металлов обычно значительно меньше радиусов атомов того же металла. Это связано с потерей или приобретением электронов при образовании ионов, что приводит к уменьшению электронной оболочки и, следовательно, к сокращению размера иона. Таким образом, ионы металлов обладают большими зарядами и меньшими размерами по сравнению с атомами металлов.
2. Связь между валентностью и радиусами ионов
Валентность металлов часто определяет их способность образовывать ионы. Ион радикального металла может представлять собой только маленькую часть полного атома, а ион двухатомного металла может быть значительно больше. Следовательно, при увеличении валентности, радиус иона уменьшается.
3. Таблица радиусов ионов металлов
Таблица радиусов ионов металлов позволяет сравнить размеры ионов разных металлов. Обычно радиусы ионов указываются в пикометрах (1 пикометр равен 1 * 10^-12 метра). Чем больше заряд иона, тем меньше его радиус, поэтому в таблице радиусов ионов металлов, заряд иона указывается в верхнем индексе.
4. Влияние радиусов ионов на свойства металлов
Размеры ионов металлов играют важную роль в их химических свойствах. Например, маленькие ионы металлов имеют большую электроотрицательность и могут образовывать более ковалентные связи. Большие ионы могут быть более полярными и менее стабильными. Размер иона также влияет на его способность образовывать комплексы и реагировать с другими соединениями.
5. Значение радиусов ионов для определения структуры соединений
Размер ионов металлов может определять структуру и связи в соединениях. Например, различные радиусы ионов металлов могут приводить к образованию разных типов кристаллических структур. Размеры ионов также могут влиять на силу связи между ионами и степень их сгруппированности в кристаллической решетке.
В целом, радиусы ионов металлов имеют важное значение для понимания и предсказания их химических свойств, структуры соединений и влияния этих свойств на различные процессы и реакции.
Влияние электронной конфигурации на радиус ионов
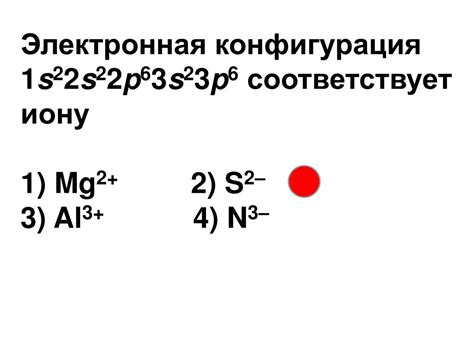
Радиус иона — это расстояние от ядра иона до его внешней электронной оболочки. Величина ионного радиуса зависит от ряда факторов, включая электронную конфигурацию атома.
Электронная конфигурация определяет количество электронов в каждой энергетической оболочке атома, что в свою очередь влияет на взаимодействие атома с другими атомами и на образование ионов.
Например, металлы из группы 1 и 2 периодической системы (щелочные металлы и щелочноземельные металлы) имеют электронную конфигурацию, где внешние электроны находятся в s-подуровне. Такие металлы образуют катионы, у которых радиус значительно меньше, чем у соответствующих нейтральных атомов. Это связано с эффективным экранированием внешних электронов, что позволяет эффективно притягивать ионы к ядру.
В то же время, атомы переходных металлов имеют сложную электронную конфигурацию, включая d- и f-подуровни. Переходные металлы имеют переменный радиус ионов в зависимости от степени окисления. Это связано с участием d-электронов в образовании связей и их способностью перемещаться между различными энергетическими уровнями.
Таким образом, электронная конфигурация атомов металлов оказывает существенное влияние на радиус ионов. Это объясняет различия в радиусах ионов между разными группами металлов и даже внутри одной группы в зависимости от степени окисления.
Сравнение радиусов ионов различных металлов

Радиус иона является важным показателем при изучении свойств металлов. Он определяет размер частицы и влияет на многочисленные физические и химические свойства металлов. В таблице представлены значения радиусов ионов различных металлов, которые позволяют провести сравнительный анализ.
1. Алкальные металлы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs). Радиусы ионов этих металлов возрастают при движении от лития к цезию. Это связано с увеличением числа электронов и протонов внутри ядра.
2. Щелочноземельные металлы: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba). Радиусы ионов щелочноземельных металлов также возрастают при движении по периоду. Однако они меньше, чем радиусы ионов алкальных металлов.
3. Переходные металлы: железо (Fe), медь (Cu), цинк (Zn), никель (Ni), кобальт (Co). Радиусы ионов переходных металлов имеют различные значения в зависимости от степени окисления. В целом, радиусы ионов переходных металлов меньше, чем у алкальных и щелочноземельных металлов.
4. Постпереходные и пониженных Главгрупп металлы: олово (Sn), свинец (Pb), сурьма (Bi), висмут (Bi). Радиусы ионов этих металлов больше, чем радиусы атомов, что связано с наличием дополнительных электронов на внешней оболочке.
5. Редкоземельные металлы: лантан (La), церий (Ce), празеодим (Pr), неодим (Nd), прометий (Pm). Радиусы ионов редкоземельных металлов постепенно увеличиваются со снижением атомного номера. Однако, эти значения могут отличаться, в зависимости от степени окисления металла.
Таким образом, сравнение радиусов ионов различных металлов позволяет выявить закономерности и объяснить различные характеристики их свойств.
Вопрос-ответ

Какие факторы влияют на радиус ионов металлов?
Радиус ионов металлов зависит от нескольких факторов, включая атомный радиус, валентность ионов, заряд ионов, а также степень ионизации. В основном, радиус ионов металлов уменьшается с увеличением заряда ионов и с увеличением валентности ионов. Также, чем больше степень ионизации, тем меньше радиус иона.
Какие металлы имеют самые маленькие радиусы ионов?
В таблице радиусов ионов металлов самыми маленькими радиусами обладают ионы лития, натрия, калия, магния, бериллия и алюминия. Эти металлы имеют высокую зарядность ионов и образуют ионы маленького размера в своих соединениях.
Какие металлы имеют самые большие радиусы ионов?
Металлы с самыми большими радиусами ионов в таблице - это металлы группы 1 (литий, натрий, калий) и группы 2 (магний, кальций, стронций, барий, радий). У этих металлов имеется низкая зарядность ионов и большой атомный радиус, поэтому ионы, образуемые ими, имеют больший размер.
Есть ли закономерности в изменении радиусов ионов металлов?
Да, существуют некоторые закономерности в изменении радиусов ионов металлов в таблице. Например, в пределах одной группы (вертикали) таблицы, радиус ионов увеличивается с увеличением порядкового номера элемента. В пределах одного периода (горизонтали) таблицы, радиус ионов уменьшается слева направо, так как заряд ядра увеличивается, притягивая электроны к ядру и уменьшая размер иона.
Какие особенности стоит отметить в таблице радиусов ионов металлов?
В таблице радиусов ионов металлов можно заметить несколько особенностей. Например, размер ионов металлов с увеличением валентности может уменьшаться или оставаться примерно одинаковым. Также, радиус ионов металлов может различаться в разных степенях ионизации. Например, размер ионов железа в трехвалентной степени ионизации будет больше, чем размер ионов железа в двухвалентной степени ионизации.
