Один из основных параметров, определяющих химические свойства элементов, - это их атомные радиусы. Атомный радиус - это расстояние от ядра атома до его внешней электронной оболочки. В таблице Менделеева можно увидеть закономерности изменения атомных радиусов металлов по периоду.
В общем случае, атомные радиусы металлов увеличиваются по мере движения отлево направо в периоде. Это связано с тем, что с увеличением атомного номера число электронов в атоме тоже увеличивается. Каждый следующий элемент имеет на одно электронное облако больше, чем предыдущий. Увеличение числа электронов приводит к увеличению радиуса атома, так как электроны отталкиваются друг от друга и "расширяют" атом.
Существует одно исключение из этого правила - группа переходных металлов. Радиусы атомов переходных металлов в середине периода меньше, чем у металлов в начале и конце периода. Это связано с тем, что у переходных металлов на последней заполненной энергетической уровне находятся d-электроны, которые экранируют его от внешних s- и p-электронов. Это приводит к сжатию атома и, соответственно, к уменьшению его радиуса.
Знание радиусов атомов металлов по периоду позволяет установить закономерности в химическом поведении элементов и использовать их для создания новых соединений и материалов с определенными свойствами.
Атомные радиусы металлов первого периода

Металлы, расположенные в первом периоде таблице Менделеева, обладают различными атомными радиусами, которые являются важными характеристиками для понимания их физических и химических свойств.
Первым элементом первого периода является водород (H). У атома водорода самый маленький атомный радиус среди всех элементов. Его малая масса и одиночный электрон в валентной оболочке определяют эту особенность. Атомный радиус водорода составляет около 53 пикометра (1 пикометр = 10^-12 метров).
Другим металлом первого периода является литий (Li). Литий имеет на один электрон больше, чем водород, в своей внешней оболочке. Из-за этого его атомный радиус немного больше и составляет около 152 пикометра.
Бериллий (Be) также относится к металлам первого периода. У него в валентной оболочке находятся уже два электрона. Это приводит к еще большему увеличению атомного радиуса, который составляет около 112 пикометров.
Атомные радиусы металлов первого периода продолжают увеличиваться по мере движения по таблице Менделеева. Натрий (Na), магний (Mg) и алюминий (Al) имеют соответственно атомные радиусы около 186, 160 и 143 пикометров.
Таким образом, атомные радиусы металлов первого периода увеличиваются по мере движения от водорода к алюминию. Это связано с увеличением количества электронов в валентной оболочке и их отталкивающим влиянием, что приводит к расширению размеров атомов.
Атомные радиусы металлов второго периода
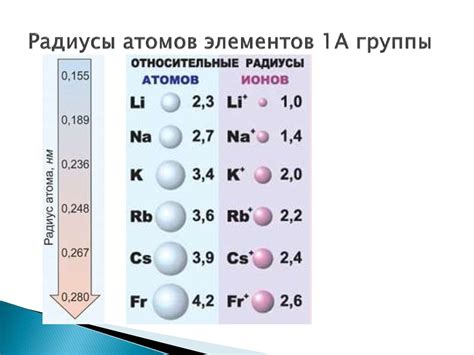
Второй период таблицы Менделеева включает в себя элементы от лития (Li) до неона (Ne). В этом периоде находятся как металлы, так и неметаллы. Одним из важных параметров атома является его атомный радиус. Атомный радиус представляет собой расстояние от центра ядра до наружного электрона.
Металлы второго периода, такие как литий (Li), бериллий (Be), бор (B), углерод (C), азот (N), кислород (O) и фтор (F), имеют различные атомные радиусы, обусловленные различиями в их электронной структуре и количестве электронов в атоме.
Наименьший атомный радиус среди металлов второго периода имеет литий (Li) из-за наличия всего одного электрона в внешней оболочке, а наибольший радиус у фтора (F), который имеет наибольшее количество электронов в оболочке.
Атомные радиусы металлов второго периода можно сравнить в таблице:
| Элемент | Атомный радиус (нм) |
|---|---|
| Литий (Li) | 0.152 |
| Бериллий (Be) | 0.111 |
| Бор (B) | 0.080 |
| Углерод (C) | 0.077 |
| Азот (N) | 0.071 |
| Кислород (O) | 0.060 |
| Фтор (F) | 0.057 |
Таким образом, атомные радиусы металлов второго периода меняются в зависимости от количества электронов в внешней оболочке и их расположения в атоме.
Атомные радиусы металлов третьего периода

Металлы третьего периода периодической системы Менделеева включают s- и p-элементы, такие как натрий (Na), магний (Mg), алюминий (Al) и кремний (Si). Атомные радиусы этих металлов можно рассмотреть в контексте их положения в периоде и структуре атома.
Натрий (Na) - это алкалий, и его атомный радиус составляет около 186 пикометров (pm). Атомный радиус натрия относительно большой из-за наличия только одного электрона в своей внешней электронной оболочке.
Магний (Mg) - это щелочноземельный металл, и его атомный радиус равен примерно 160 пикометрам (pm). В отличие от натрия, магний имеет два электрона в своей внешней электронной оболочке, что делает его атомный радиус меньше на фоне натрия.
Алюминий (Al) - это постпереходный металл, и его атомный радиус составляет примерно 125 пикометров (pm). Вместе с тем, алюминий имеет орбитальный электрон в своей третьей внешней электронной оболочке, что делает его атомный радиус больше, чем у магния.
Кремний (Si) - это полуметалл, и его атомный радиус составляет около 117 пикометров (pm). Кремний имеет орбитальные электроны в третьей и четвёртой внешних электронных оболочках, что делает его атомный радиус меньше на фоне алюминия.
Таким образом, атомные радиусы металлов третьего периода постепенно уменьшаются от натрия до кремния, что объясняется изменением структуры атома и наличием различного количества орбитальных электронов в их внешних электронных оболочках.
Атомные радиусы металлов четвертого периода
В таблице Менделеева четвертый период представлен элементами, атомные радиусы которых имеют свои особенности. В этом периоде находятся металлы, которые обладают определенными характеристиками и свойствами.
Атомные радиусы металлов четвертого периода изменяются в зависимости от их положения в периоде и химической структуры. Общим трендом является увеличение радиусов отлево направо в периоде, а также увеличение радиусов от верхушки периода к его основанию.
Наибольший атомный радиус в четвертом периоде имеет калий (K), который является иннертной алкалиеметаллическим группы и занимает крайнее правое положение в периоде. Важно отметить, что калий обладает самой низкой электроотрицательностью среди элементов этого периода.
Следующим по величине атомного радиуса является кальций (Ca), который также относится к алкалиноземельным металлам, но уже катионам, и занимает второе правое положение в периоде.
Далее идут транзиционные металлы, такие как титан (Ti), ванадий (V), хром (Cr) и марганец (Mn). Эти элементы имеют более маленькие атомные радиусы по сравнению с предыдущими металлами в периоде и характеризуются своей высокой твердостью, прочностью и устойчивостью к окислению.
Атомные радиусы металлов пятого периода
В таблице Менделеева металлы пятого периода находятся в группах 3B, 4B, 5B, 6B, 7B и 8B. Атомные радиусы металлов этого периода возрастают по мере движения слева направо в каждой группе.
В группе 3B находятся металлы скандий (Sc), иттрий (Y) и лантан (La). Скандий имеет меньший атомный радиус, чем иттрий, иттрий же имеет меньший атомный радиус по сравнению с лантаном. Это можно объяснить тем, что при перемещении слева направо в периоде, эффективное ядро становится более заряженным, что притягивает электроны к ядру.
В группе 4B находятся металлы титан (Ti), цирконий (Zr) и гафний (Hf). В данной группе также наблюдается увеличение атомного радиуса по мере движения слева направо. Так, атомный радиус титана меньше, чем радиус циркония, атомный радиус циркония меньше, чем радиус гафния.
Группа 5B включает металлы ванадий (V), ниобий (Nb) и тантал (Ta). Атомные радиусы металлов этой группы также увеличиваются в направлении слева направо. Так, атомный радиус ванадия меньше, чем радиус ниобия, атомный радиус ниобия меньше, чем радиус тантала. Это также объясняется взаимодействием электронов со связанными с ядром энергетическими уровнями.
Металлы группы 6B - хром (Cr), молибден (Mo) и вольфрам (W) - также не являются исключением. Атомные радиусы в этой группе также увеличиваются по мере движения слева направо - радиус хрома меньше, чем радиус молибдена, атомный радиус молибдена меньше, чем радиус вольфрама.
В группах 7B и 8B находятся металлы марганец и фермий. Атомные радиусы в этих группах также увеличиваются слева направо. Марганец имеет меньший атомный радиус по сравнению с фермии, что снова связано с увеличением заряда эффективного ядра при переходе из одной группы в другую.
Атомные радиусы металлов шестого периода

Атомный радиус металлов шестого периода в таблице Менделеева возрастает по мере приближения к концу периода. Периодическая система элементов позволяет сравнивать размеры атомов металлов и устанавливать закономерности в их изменении.
Самым маленьким атомным радиусом в шестом периоде обладает металл осмий (Os). Его атомный радиус составляет около 130 пикометров (1 пикометр равен 10^-12 метра). Осмий является одним из самых плотных элементов и обладает высокой температурой плавления.
Далее, по мере приближения к концу периода, атомные радиусы металлов увеличиваются. Рутений (Ru) имеет атомный радиус примерно 134 пикометра. Родий (Rh) имеет радиус около 135 пикометров. Палладий (Pd) имеет радиус примерно 140 пикометров.
Серебро (Ag) является одним из самых распространенных металлов. Его атомный радиус составляет примерно 144 пикометра. Сверху по периоду находится кадмий (Cd) с атомным радиусом около 151 пикометра.
Завершает шестой период таблицы Менделеева металл индий (In) с атомным радиусом около 167 пикометров. Индий используется, например, в производстве полупроводниковых материалов и покрытий.
Атомные радиусы металлов седьмого периода
Периодическая таблица Менделеева содержит информацию о различных характеристиках элементов, включая их атомные радиусы. В данном случае рассмотрим атомные радиусы металлов седьмого периода.
Седьмой период в таблице Менделеева включает металлы, которые располагаются с 57 по 71 элементы. Эти элементы известны как лантаноиды и имеют свою специфическую химическую сущность. Атомные радиусы металлов седьмого периода меняются в зависимости от атомного номера элемента.
Наибольший атомный радиус седьмого периода имеет самый первый элемент - лантан (La), который имеет атомный номер 57. Его атомный радиус составляет около 187 пикометров. По мере увеличения атомного номера металлов седьмого периода, их атомные радиусы уменьшаются.
Второй элемент седьмого периода - церий (Ce) - имеет атомный радиус около 181 пикометра. Последующие элементы, такие как прасеодим (Pr) и неодим (Nd), имеют атомные радиусы около 182 и 181 пикометра соответственно.
Атомные радиусы металлов седьмого периода продолжают снижаться далее, и самый маленький атомный радиус седьмого периода имеет последний элемент - лютетий (Lu). Его атомный радиус составляет около 159 пикометров.
Таким образом, атомные радиусы металлов седьмого периода уменьшаются по мере увеличения атомного номера элемента. Это связано с увеличением заряда ядра и притягивающего электронов к ядру. Знание атомных радиусов металлов позволяет лучше понять их свойства и химические реакции, в которых они участвуют.
Вопрос-ответ

Какие металлы имеют наибольший радиус атома в своих периодах?
Металлы, находящиеся слева в периоде таблицы Менделеева, имеют наибольший радиус атома. Например, калий во втором периоде и цезий в шестом периоде имеют наибольшие радиусы атомов в своих периодах.
Как радиус атомов металлов меняется по периоду в таблице Менделеева?
Радиус атомов металлов обычно уменьшается по мере перехода от левого к правому концу периода. Это объясняется эффективным притяжением электронов ядром атома в связи с увеличением зарядового числа ядра.
Как радиус атомов металлов меняется по группе в таблице Менделеева?
Радиус атомов металлов обычно увеличивается по мере перехода от верхней к нижней группе. Это объясняется увеличением количество энергетических уровней электронов в атоме.
Как связана электронная конфигурация атомов металлов с их радиусами?
Электронная конфигурация атомов металлов определяет их радиусы. Атомы металлов, у которых электроны распределены на более удаленных от ядра энергетических уровнях, имеют больший радиус, чем атомы с ближними энергетическими уровнями.
Каким образом можно определить радиус атома металла?
Радиус атома металла можно определить на основе его половинного межатомного расстояния с другими атомами в кристаллической решетке или на основе экспериментальных данных, полученных с использованием методов рентгеноструктурного анализа или электронной микроскопии.
