Различные химические элементы в периоде в таблице Менделеева варьируются не только по своим химическим свойствам, но и по размерам атомов. Особенно ярко это проявляется при сравнении металлов и неметаллов. Почему же размеры атомов данных групп элементов различаются, несмотря на наличие общего периодического закона?
Причина различий в размерах атомов металлов и неметаллов в периоде заключается в особенностях строения и электронной конфигурации атомов этих элементов. У металлов атомы имеют малое количество валентных электронов, что делает их более компактными и малогабаритными. В то же время, атомы неметаллов имеют большее количество валентных электронов, что приводит к увеличению их размеров и распределению электронов на более широком области пространства.
Электронная структура атомов металлов позволяет им образовывать ковалентные связи с другими атомами металла, образуя металлическую решетку. Это, в свою очередь, позволяет атомам металлов быть ближе друг к другу и образовывать компактную структуру. Атомы неметаллов, напротив, не образуют таких ковалентных связей и имеют склонность образовывать ионные или ковалентные связи с атомами других элементов. В результате этого, атомы неметаллов занимают больше пространства и их размеры увеличиваются.
Периоды в таблице Менделеева: почему размеры атомов в них различаются?
Таблица Менделеева является основой для организации химических элементов по возрастанию их атомных номеров и химических свойств. В таблице установлены периоды, которые представляют собой строки, содержащие элементы с аналогичным количеством электронных оболочек. Размеры атомов в каждом периоде различаются по нескольким причинам.
В первую очередь, размер атома зависит от количества электронных оболочек и электронных уровней. Чем больше у атома электронных оболочек, тем больше его размер. Поэтому в каждом периоде с увеличением атомного номера количество электронных оболочек и размер атомов увеличивается.
Второй фактор, влияющий на размер атомов в периодах, - это эффективное зарядное ядро атома. Чем сильнее зарядное ядро удерживает электроны, тем меньше размер атома. Эффективность зарядного ядра зависит от атомного радиуса, электронной конфигурации и заряда ядра. В каждом периоде атомы с более высоким атомным номером имеют большее количество протонов в ядре, что делает их зарядное ядро сильнее и эффективнее, поэтому размеры атомов в периодах уменьшаются.
Третий фактор, важный для определения размеров атомов в периодах, - это взаимодействие между электронами в оболочках. Атомы с большим количеством электронов в оболочках будут иметь большую отталкивающую силу между ними, что приводит к увеличению размера атома. В каждом периоде с ростом атомного номера количество электронов в оболочках увеличивается, что приводит к увеличению взаимодействия между ними и увеличению размеров атомов.
Таким образом, различие в размерах атомов в каждом периоде таблицы Менделеева обусловлено количеством электронных оболочек, эффективностью зарядного ядра и взаимодействием между электронами в оболочках. Эти факторы определяют химические свойства элементов и позволяют классифицировать их в таблице Менделеева по периодам.
Важность понимания размеров атомов

Понимание размеров атомов является важным фактором в изучении свойств материалов и их химического поведения. Размеры атомов могут оказывать существенное влияние на физические и химические свойства вещества, такие как плотность, теплопроводность, температура плавления и растворимость. Также размеры атомов могут влиять на структуру кристаллической решетки материала и его механические свойства.
В периоде таблицы Mendeleev, размеры атомов металлов и неметаллов могут значительно различаться. Это связано с различием в электронной структуре атомов. Металлы обычно имеют меньшую электроотрицательность и большую атомную радиус по сравнению с неметаллами. Больший размер атомов металлов связан с их более слабой электронной оболочкой и сильной экранирующей способностью ядра. В то же время, неметаллы имеют меньший атомный радиус из-за их высокой электроотрицательности и сильного притяжения ядра к электронам.
Благодаря пониманию разницы в размерах атомов металлов и неметаллов, можно предсказывать и объяснять реакционную способность материала. Например, большие атомы металлов могут легко отдавать электроны и образовывать положительные ионы, тогда как маленькие атомы неметаллов обычно принимают электроны и образуют отрицательные ионы. Это различие в реакционной способности приводит к образованию ионных связей и влияет на свойства соединений металлов и неметаллов.
Основные различия между металлами и неметаллами

Металлы и неметаллы - две основные группы элементов периодической таблицы, отличающиеся во многих своих характеристиках.
1. Физические свойства: Металлы обладают хорошей электропроводностью и теплопроводностью, в то время как неметаллы являются плохими проводниками электричества и тепла.
2. Окислительные свойства: Металлы имеют свойство активно вступать в химические реакции с кислородом, образуя оксиды, в то время как неметаллы могут выступать в качестве окислителей или вступать в реакции с металлами, образуя соли.
3. Структура атомов: Металлы обладают большими атомами со слабыми связями между атомами, что позволяет им легко искристаллизоваться и образовывать металлическую решетку. Неметаллы, напротив, имеют более маленькие атомы с сильными связями между ними, что делает их несколько хрупкими и несвойственными металлической решетке.
4. Свойства связи: В металлах связь между атомами является металлической, что позволяет электронам свободно двигаться в решетке, что делает металлы хорошими проводниками электричества и тепла. В неметаллах связь между атомами обычно является ковалентной, что делает их хорошими изоляторами.
5. Химические свойства: Металлы легко образуют положительные ионы, расположенные слева в периодической таблице, а неметаллы имеют тенденцию образовывать отрицательные ионы, расположенные справа в периодической таблице.
6. Ближайшие соседи: Металлы обычно окружены металлами в периодической таблице, а неметаллы окружены другими неметаллами.
Итак, металлы и неметаллы имеют значительные различия в своих свойствах и структуре атомов, что влияет на их химические и физические свойства. Понимание этих различий помогает нам лучше понять природу и использование этих элементов в различных отраслях науки и промышленности.
Влияние электронной конфигурации на размеры атомов
Размеры атомов металлов и неметаллов в одном периоде различаются из-за их электронной конфигурации. Атомы металлов обладают большими размерами, так как у них внешние электронные оболочки содержат относительно мало электронов и несколько позволительных энергетических зон. Неметаллы же имеют меньшие размеры атомов, поскольку их внешние электронные оболочки содержат большее количество электронов и обладают заполненными энергетическими зонами.
В металлах атомные радиусы постепенно увеличиваются с увеличением зарядового числа, что объясняется дополнением внешней электронной оболочки новыми электронами. При этом атомы металлов с более положительным зарядом имеют больше электронных оболочек, что приводит к увеличению их размеров.
В случае неметаллов, атомные радиусы уменьшаются с увеличением зарядового числа, так как атомы неметаллов имеют более узкие электронные оболочки и более плотно заполненные энергетические зоны. Это означает, что атомы неметаллов имеют более высокую эффективность притяжения электронов и, следовательно, меньшие размеры.
Таким образом, электронная конфигурация атомов металлов и неметаллов определяет их размеры в одном периоде. Металлы, имеющие более широкие электронные оболочки и несколько позволительных энергетических зон, обладают большими размерами атомов. Неметаллы же, с более узкими электронными оболочками и более заполненными энергетическими зонами, имеют меньшие размеры атомов.
Причины различий в размерах атомов металлов в одном периоде
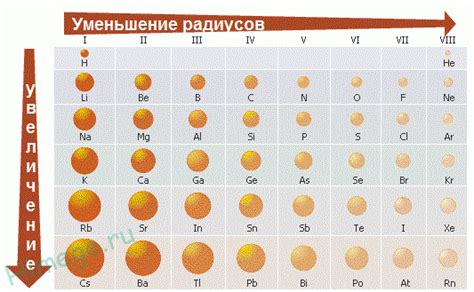
Различия в размерах атомов металлов в одном периоде обусловлены несколькими факторами. Во-первых, атомы металлов имеют большую электронную оболочку, которая состоит из внутренних энергетических уровней и внешней валентной оболочки. Количество электронов в валентной оболочке может различаться у разных металлов, и это влияет на их размеры.
Во-вторых, металлы характеризуются большим радиусом атомов, так как у них присутствует металлическая связь. Металлическая связь образуется между положительно заряженными ионами металла и свободно движущимися электронами. Эти свободно движущиеся электроны образуют "электронное облако", которое помогает поддерживать форму и размеры металлического атома.
В-третьих, активные металлы имеют тенденцию образовывать ионные соединения с неметаллами, особенно с галогенами. При образовании ионных соединений, атомы металлов отдают электроны, что ведет к уменьшению их размеров. Это объясняется тем, что при потере электронов, электронная оболочка металла становится меньше, и атом сжимается.
Наконец, металлы в одном периоде также отличаются своим положением в таблице химических элементов, что влияет на их размеры. С увеличением атомного номера, атомы металлов имеют больше протонов и нейтронов в ядре, что приводит к увеличению их размеров.
Причины различий в размерах атомов неметаллов в одном периоде

Различия в размерах атомов неметаллов в одном периоде могут быть связаны с несколькими факторами. Один из них - количество электронов во внешней оболочке атома. Чем больше электронов в оболочке, тем более "набалансированным" становится атом и его размер увеличивается.
Другой фактор, влияющий на размер атомов неметаллов, - электронная конфигурация. Конфигурация электронов может отличаться у разных элементов, что приводит к разнице в величине и распределении электронных облаков атомов.
Также влияние на размер атомов неметаллов оказывают внешние факторы, такие как давление и температура. При повышении давления атомы сжимаются, а при понижении - расширяются. Температура также влияет на размер атомов, поскольку под ее воздействием происходят изменения в структуре и взаимодействии атомов.
Внутренние электростатические силы и взаимодействия между атомами также сказываются на размере атомов неметаллов в одном периоде. При отрицательном заряде электронных облаков электростатическое отталкивание атомов может привести к расширению атомов, а при положительном заряде - к сжатию.
В целом, размер атомов неметаллов в одном периоде определяется сложным взаимодействием многочисленных факторов, таких как количество электронов, электронная конфигурация, давление, температура и электростатические силы. Поэтому наблюдаются различия в размерах атомов неметаллов в одном периоде.
Выводы и применение полученных знаний

Изучение размеров атомов металлов и неметаллов в одном периоде позволило сделать несколько выводов. Во-первых, металлы обычно имеют больший размер атома по сравнению с неметаллами. Это связано с особенностями строения и электронной структуры атомов.
Металлы имеют меньшее количество электронов во внешней оболочке, что делает их атомы более крупными. Неметаллы же имеют большее количество электронов в внешней оболочке, что приводит к более маленькому размеру атомов.
Данные знания о размерах атомов металлов и неметаллов в одном периоде имеют применение в различных областях. Например, в химической промышленности они могут использоваться при разработке новых материалов и сплавов. Знание размеров атомов позволяет предсказывать и контролировать их свойства, что важно при создании материалов с определенными химическими, физическими и механическими характеристиками.
Также, данные о размере атомов металлов и неметаллов могут быть полезны при изучении и анализе соединений и реакций между ними. Изменения в размерах атомов могут влиять на химическую активность и стабильность соединений, помогая понять и объяснить их свойства и реакционную способность.
Вопрос-ответ

Почему у металлов и неметаллов разные размеры атомов в одном периоде?
Разные размеры атомов металлов и неметаллов в одном периоде обусловлены различием в их атомных структурах. Металлы обладают малыми радиусами атомов, так как они имеют большую электронную оболочку и слабые электростатические взаимодействия между атомами. Неметаллы, напротив, имеют большие радиусы атомов из-за наличия большого количества электронов в валентной оболочке и сильных электростатических взаимодействий.
Какие факторы влияют на размеры атомов металлов и неметаллов?
Размеры атомов металлов и неметаллов зависят от нескольких факторов. Одним из них является количество электронов в валентной оболочке: у металлов в валентной оболочке находится относительно мало электронов, поэтому их атомы имеют меньший радиус. Неметаллы, напротив, имеют большое количество электронов в валентной оболочке, что делает их атомы более объемными. Кроме того, силы электростатического взаимодействия между атомами также влияют на размеры: у металлов эти силы слабее, а у неметаллов - сильнее.
