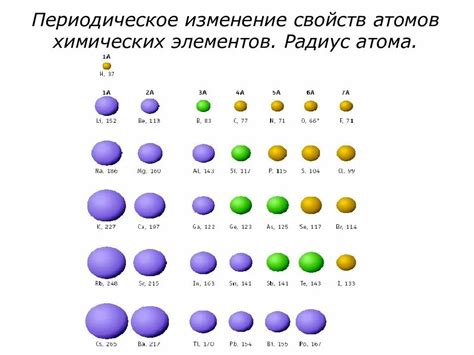
Металлы и неметаллы — две основные категории элементов, которые обладают существенными различиями в своих физических и химических свойствах. Одним из основных отличий металлов от неметаллов является их радиус атомов. Так, радиус атомов металлов, в среднем, оказывается больше, чем у неметаллов. Это значимая характеристика, которая оказывает влияние на различные свойства и поведение атомов металлов и неметаллов.
Разница в радиусе атомов металлов и неметаллов связана с их строением и электронной конфигурацией. Металлы обладают относительно малой электронной аффинностью и ионизационной энергией, что обуславливает их способность отдавать электроны и образовывать положительные ионы. В химических соединениях атомы металлов обычно имеют положительный заряд, что связано с потерей одного или нескольких электронов.
В отличие от металлов, неметаллы обладают большей электронной аффинностью и ионизационной энергией, что делает их более склонными к приобретению электронов и образованию отрицательных ионов. В химических соединениях атомы неметаллов обычно имеют отрицательный заряд, что связано с приобретением одного или нескольких электронов.
Таким образом, разница в радиусе атомов металлов и неметаллов связана с их способностью образовывать положительные и отрицательные ионы, что в свою очередь влияет на их химические свойства и взаимодействия.
Повышенный радиус атомов металлов также связан с тем, что в них главный раздел элемента занимает довольно широкое пространство. Кроме того, атомы металлов обладают малой электронной плотностью и подвижными электронами, что способствует увеличению их радиуса. В свою очередь, неметаллы обладают высокой электронной плотностью и жесткой электронной оболочкой, что приводит к меньшему радиусу атомов.
Почему радиус атомов металлов больше?

Радиус атома - это расстояние от ядра атома до внешней электронной оболочки. У металлов радиус атомов обычно больше, чем у неметаллов. Это связано с особенностями строения и взаимодействия атомов в металлах.
Одним из факторов, влияющих на радиус атомов металлов, является структура кристаллической решетки. Металлы образуют кристаллическую решетку, в которой атомы металла располагаются в определенном порядке. Это позволяет атомам металла занимать устойчивое положение и иметь более большое пространство для распределения электронов по внешним энергетическим уровням.
Кроме того, у металлов обычно более высокая степень ионизации и электроотрицательность, что означает, что они имеют меньший недостаток электронов во внешних энергетических уровнях. Из-за этого атомы металлов меньше притягивают электроны, что приводит к увеличению их радиуса.
Также стоит упомянуть, что у металлов обычно большое число свободных электронов, которые способны перемещаться в металлическом кристалле. Это явление называется электронная проводимость. Свободные электроны создают дополнительное пространство в металлической решетке и способствуют увеличению радиуса атомов металлов.
Химическая структура металлов
Металлы представляют собой группу химических элементов, которые обладают определенными характеристиками и структурой. Их атомы обычно образуют кристаллическую решетку, в которой положительно заряженные ядра атомов окружены облаком электронов, свободно перемещающихся по решетке.
Особенностью структуры металлов является наличие так называемой "электронной оболочки". В отличие от неметаллов, у которых электроны заполняют последовательно оболочки, у металлов электроны могут находиться на разных уровнях энергии, образуя так называемую "область свободных электронов". Это делает металлы хорошими проводниками электрического тока и тепла.
Радиус атомов металлов обычно больше, чем у неметаллов. Это связано с тем, что в металлах электроны находятся на большем расстоянии от ядра, что позволяет атомам быть более "растянутыми". Кроме того, металлы имеют выраженную металлическую связь, при которой валентные электроны образуют облако свободно движущихся частиц, что также влияет на их радиус.
Химическая структура металлов также определяет их другие характеристики, такие как светопропускание, магнитные свойства и твердость. Некоторые металлы обладают способностью образовывать сплавы с другими металлами, что расширяет их применение в промышленности.
Электронная конфигурация и радиус атомов
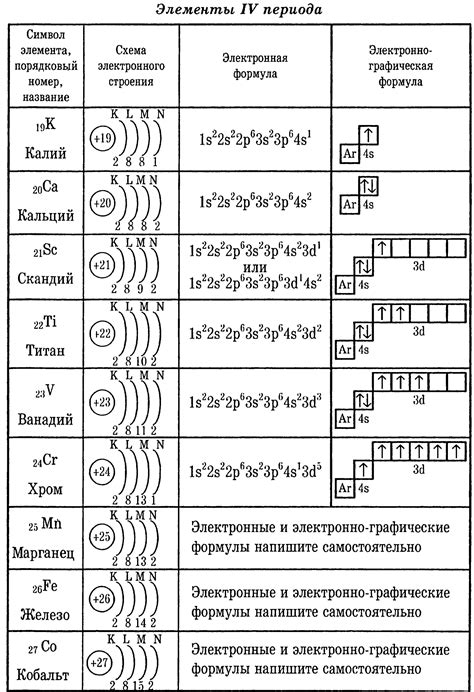
Электронная конфигурация атома металла определяется распределением его электронов по энергетическим уровням и подуровням. Каждый уровень состоит из подуровней, а каждый подуровень содержит максимально возможное число электронов. Процесс распределения электронов определяет химические свойства элементов, включая их радиусы атомов.
Так как металлы обладают низкими значениями энергии ионизации, у них на внешнем уровне обычно есть только несколько электронов, которые слабо притягиваются ядром атома. Это обеспечивает металлам возможность образовать множество атомных связей и обладать металлическими свойствами, такими как проводимость тепла и электричества.
Радиус атомов металлов больше, чем у неметаллов, из-за специфического расположения электронов в их электронных оболочках. У атомов металлов есть несколько энергетических уровней с электронами, что приводит к образованию больших оболочек вокруг ядра. Протоны ядра отталкиваются друг от друга, а электроны отталкиваются друг от друга и притягиваются к ядру, что приводит к увеличению радиуса атома металла.
Также стоит отметить, что радиус атомов металлов может изменяться в зависимости от их положения в периодической системе. Например, в периоде металлы имеют в среднем больший радиус, чем неметаллы, но внутри периода радиус атомов увеличивается от неметаллов к металлам.
В целом, электронная конфигурация играет ключевую роль в определении радиусов атомов металлов. Больший радиус металлических атомов обусловлен их специфическим расположением электронов в электронных оболочках и свойствами металлов.
Взаимодействие электронов в металлах
Взаимодействие электронов в металлах играет важную роль в определении размеров атомов их радиусами. Внутри металлических соединений электроны образуют так называемое "электронное облако", которое является свободно движущимся газом электронов.
Электроны в металлах свободно передвигаются по кристаллической решетке и не привязаны к конкретным атомам. Они могут свободно переходить от одного атома к другому, создавая эффект металлической связи. Благодаря этому, атомы металлов способны иметь более вытянутую форму и больший размер по сравнению с неметаллами, где электроны крепко связаны внутри атомов.
Именно из-за наличия электронных облаков в металлах возникает явление, известное как "поляризируемость". Большое количество свободных электронов делает металлы хорошими проводниками электричества и тепла, а также обладающими высокой электронной проводимостью.
Таким образом, взаимодействие электронов в металлах влияет на их радиусы и форму атомов, обеспечивает особые свойства металлических материалов и играет важную роль в их химической реактивности.
Эффект "количества cоседей" и увеличение радиусов атомов
Радиусы атомов металлов обычно больше, чем у неметаллов. Это можно объяснить несколькими факторами, одним из которых является эффект "количества соседей".
Когда металлический атом находится в кристаллической решетке, он окружен множеством соседних атомов. Взаимодействия между атомами создают силы притяжения, которые за счет количества соседей проявляются сильнее, чем у неметаллов. В результате этого металлические атомы имеют больший радиус.
Другим фактором, влияющим на увеличение радиусов атомов металлов, является их внутренняя структура. Атомы металлов обычно имеют много электронных уровней, что делает их больше по размеру. Этот эффект можно сравнить с "надуванием" атомной оболочки, что приводит к увеличению радиуса.
Кроме того, металлы имеют малое количество валентных электронов, что делает их более подвижными и способными "растягиваться". Это позволяет металлическим атомам занимать больше места и иметь большие радиусы. Неметаллы, напротив, имеют большое количество валентных электронов, что делает их более чувствительными к электронной плотности и ограничивает их радиусы.
В целом, комбинация эффекта "количества соседей", многоуровневой структуры и особенностей валентности делает радиусы атомов металлов значительно больше, чем у неметаллов.
Межатомное взаимодействие и радиусы атомов
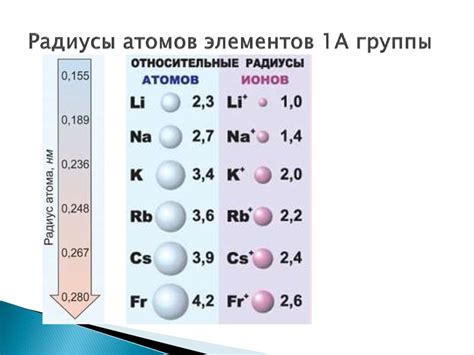
Радиус атомов металлов обычно больше, чем у неметаллов, из-за различий в их структуре и межатомном взаимодействии.
Металлы в основном образуют металлические связи, в которых свободные электроны локализуются между положительно заряженными ионами металла. Это создает сильное притяжение и позволяет атомам металла сближаться ближе друг к другу, увеличивая радиус атома.
Почему же радиус атомов металлов больше, чем у неметаллов? Неметаллы образуют ковалентные связи, в которых электроны между атомами располагаются гораздо ближе и контролируются силой их ядра. Это сильное взаимодействие заставляет атомы неметалла быть более компактными и иметь меньший радиус.
Кроме того, радиус атомов металлов также может быть больше из-за наличия дополнительных энергетических уровней в их электронных оболочках. Эти дополнительные уровни позволяют атомам металла содержать большее количество электронов и, следовательно, занимать большие объемы в пространстве.
В целом, радиус атомов металлов больше из-за характера межатомного взаимодействия и структуры их электронных оболочек. Это делает атомы металлов более "раздутыми" и позволяет им образовывать сильные металлические связи и обладать хорошей электропроводностью и теплопроводностью.
Изменение радиусов атомов с увеличением периода

Радиус атомов металлов и неметаллов зависит от двух факторов: электроотрицательности и электронной конфигурации. Периодическая таблица Менделеева показывает, что с увеличением периода радиус атомов металлов увеличивается, а у неметаллов - уменьшается.
Электроотрицательность - это способность атома притягивать электроны к себе. Металлы обладают низкой электроотрицательностью, поэтому они имеют большие атомные радиусы. Неметаллы, напротив, имеют высокую электроотрицательность и маленькие атомные радиусы.
Второй фактор, который влияет на радиусы атомов, - электронная конфигурация. При движении слева направо по периоду, количество энергетических уровней увеличивается. Это приводит к увеличению размера атомов металлов, так как добавляются новые энергетические уровни. У неметаллов, количество энергетических уровней остается примерно постоянным, что не дает им увеличивать свои радиусы атомов.
Таким образом, изменение радиусов атомов с увеличением периода можно объяснить с помощью электроотрицательности и электронной конфигурации. Металлы имеют большие атомные радиусы из-за их низкой электроотрицательности и добавления новых энергетических уровней. Неметаллы, наоборот, имеют маленькие атомные радиусы из-за их высокой электроотрицательности и отсутствия увеличения количества энергетических уровней с увеличением периода.
Вопрос-ответ

Почему радиус атомов металлов больше, чем у неметаллов?
Размер атомов зависит от их электронной оболочки и устроен таким образом, что для атомов металлов характерен больший размер, чем для атомов неметаллов.
Какова причина того, что радиус атомов металлов больше, чем у неметаллов?
Существует несколько факторов, определяющих размер атомов, и одним из них является структура кристаллической решетки. В металлах кристаллическая решетка имеет определенную структуру, позволяющую атомам быть расположенными более плотно и создавать более компактные структуры. В неметаллах же структура решетки не такая плотная, и атомы находятся на большом расстоянии друг от друга, что приводит к меньшему размеру атомов.
