Радиус атомов элементов 3 периода таблицы Д.И. Менделеева имеет интересные закономерности и изменения. Периодический закон указывает на увеличение радиуса атомов отлёжащих на своих концах элементов 3 периода. Щелочные металлы, такие как натрий и калий, обладают наибольшими радиусами атомов в этом периоде.
Это происходит из-за роста протонного числа и числа зарядовых ядерных частиц, входящих в состав атома. При этом электроны, располагающиеся на энергетических уровнях вокруг ядер, занимают области пространства, соприкасающиеся с другими атомами. Поэтому щелочные металлы, у которых наружный энергетический уровень содержит всего одну электронную оболочку, имеют наибольшую производную атомарного радиуса.
По мере прогрессирования по периоду к более влево от щелочных металлов находятся группы элементов, радиусы которых уменьшаются. В середине периода расположены элементы примесной происхождения, а также металлы со своеобразными физико-химическими свойствами. Они имеют более высокую плотность, в том числе атомную, и более плотно укрепленные электроны. Элементы 3-го периода включают металлы, амфотерные металлы, полуметаллы, неметаллы и галогены.
Радиус атомов элементов 3 периода
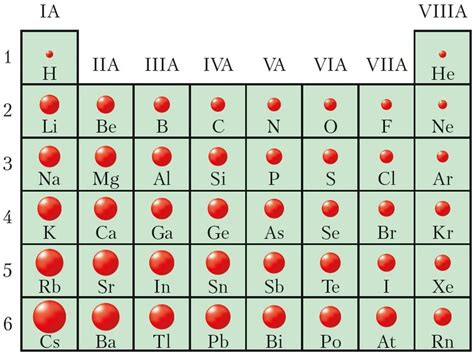
Радиус атома - характеристика размера атома, которая определяется расстоянием от его центра до внешней границы электронной оболочки. В периодической системе элементов радиусы атомов обычно увеличиваются при движении слева направо по периоду.
В 3 периоде периодической системы элементов находятся следующие элементы: натрий (Na), магний (Mg), алюминий (Al), кремний (Si), фосфор (P), сера (S), хлор (Cl), аргон (Ar).
Натрий - первый элемент 3 периода - имеет радиус атома, составляющий 186 пикометров (1 пикометр = 10^-12 метра). Магний имеет радиус атома 160 пикометров, алюминий - 143 пикометра, кремний - 111 пикометров.
Радиус атомов элементов 3 периода сокращается при движении от металлов к неметаллам. Так, у хлора радиус атома составляет всего 79 пикометров, а у аргона - 71 пикометр. Это объясняется увеличением электронного заряда и притяжения ядра к валентным электронам при увеличении номера атома.
Радиус атомов щелочных металлов
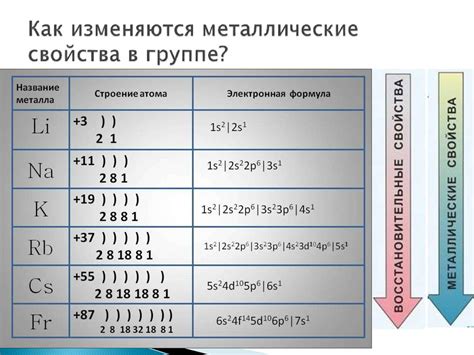
Радиус атома - это половина расстояния между ядрами атомов в молекуле. Радиус атомов щелочных металлов увеличивается по мере перемещения по периоду из левой стороны таблицы Менделеева.
Периодическая система химических элементов включает в себя группу щелочных металлов, в которую входят литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Они относятся к первой группе элементов и характеризуются наибольшим радиусом атома в своих периодах.
Литий, наименьший атом в этой группе, имеет наименьший радиус атома, который увеличивается по мере перемещения по группе вниз, и самый большой радиус атома принадлежит цезию. Это связано с увеличением количества электронных оболочек у атомов щелочных металлов и ростом числа электронов в этих оболочках.
- Литий (Li) - радиус атома: 145 пикометров (pm)
- Натрий (Na) - радиус атома: 180 pm
- Калий (K) - радиус атома: 220 pm
- Рубидий (Rb) - радиус атома: 235 pm
- Цезий (Cs) - радиус атома: 260 pm
Из приведенных данных можно сделать вывод о том, что радиусы атомов щелочных металлов увеличиваются по мере перемещения по группе вниз и достигают своего максимума у цезия.
Радиус атомов алкалиноземельных металлов
Алкалиноземельные металлы являются химической группой элементов, относящихся ко второй группе периодической системы. В этой группе находятся бериллий (Be) и магний (Mg), которые отличаются своими физическими и химическими свойствами. Радиус атомов алкалиноземельных металлов увеличивается при движении от бериллия к магнию.
Радиус атома бериллия составляет около 112 пикометров, что делает его одним из наименьших атомов во всей периодической системе. Это объясняется тем, что атом бериллия имеет очень высокую зарядовую плотность, так как в нем всего два электрона в внешней оболочке.
В отличие от бериллия, атом магния имеет больший радиус, примерно 145 пикометров. Это обусловлено наличием более сложной электронной оболочки, содержащей внешний слой из двух электронов. Таким образом, радиус атома магния больше, чем у бериллия.
Радиус атомов алкалиноземельных металлов является важным физическим свойством, влияющим на их химическое поведение и реакционную активность. Увеличение радиуса атома магния по сравнению с бериллием позволяет последнему образовывать соединения с другими элементами и проявлять химическую активность.
Радиус атомов плавкости

Радиус атома представляет собой расстояние от ядра до внешней электронной оболочки. Влияние на радиус атома оказывают физические и химические условия. Одним из таких условий является плавкость атома.
Плавкость атомов элементов 3 периода также изменяется от щелочных металлов к галогенам. Щелочные металлы имеют большой радиус атома плавкости, так как они имеют один электрон в внешней энергетической оболочке. По мере перехода к галогенам радиус атома плавкости уменьшается, так как эти элементы имеют 7 электронов во внешней энергетической оболочке и большую электроотрицательность.
По сравнению с щелочными металлами, атомы галогенов имеют более сильное электростатическое притяжение и большую кулоновскую энергию, что вызывает сжатие радиуса атома и уменьшение его плавкости. Также влияние на плавкость атомов оказывают электронные пары, орбитальные эффекты и внешние факторы, такие как температура и давление.
В таблице ниже приведены значения радиуса атомов плавкости основных элементов 3 периода:
| Элемент | Радиус атома плавкости (нм) |
|---|---|
| Натрий | 0.186 |
| Магний | 0.160 |
| Алюминий | 0.125 |
| Кремний | 0.111 |
| Фосфор | 0.098 |
| Сера | 0.088 |
| Хлор | 0.079 |
| Аргон | 0.071 |
Как видно из таблицы, радиусы атомов плавкости уменьшаются по мере перехода от щелочных металлов к галогенам, что подтверждает влияние плавкости на радиус атома элементов 3 периода.
Радиус атомов галогенов
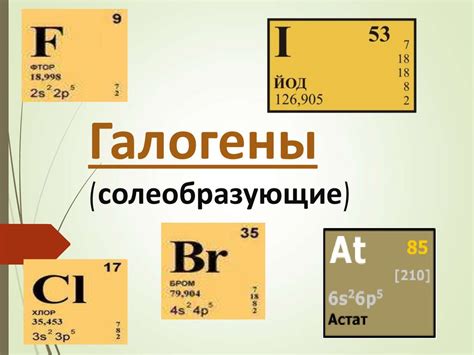
Галогены – это элементы, которые расположены в 17-й группе периодической системы химических элементов. В эту группу входят фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At). Одна из характерных особенностей галогенов – их малый атомный радиус.
Атомный радиус – это величина, определяющая размер атома. Для галогенов он увеличивается от флуора к актину. Обратное увеличение радиуса атома галогена объясняется увеличением зарядовых плотностей этих элементов, а также увеличением числа электронов внешней оболочки.
Атомный радиус галогенов увеличивается в периоде, по мере увеличения порядкового номера элемента. Это связано с увеличением числа электронных оболочек и увеличением заряда ядра. При этом радиус атома уменьшается в столбце, поскольку происходит увеличение зарядового числа ядра и уменьшение размера электронных оболочек.
Размер атома галогенов имеет важное значение для их химической активности. Больший радиус атома позволяет галогенам легко присоединяться к другим элементам, образуя стабильные химические связи. Малый радиус атома делает галогены очень реактивными и способными образовывать сильные ковалентные связи.
Вопрос-ответ

Каковы основные закономерности изменения радиуса атомов элементов 3 периода?
Радиус атомов элементов 3 периода обычно уменьшается от щелочных металлов к галогенам. Это связано с эффективностью экранирования внешних электронов внутренними энергетическими оболочками. Чем больше заряд ядра, тем сильнее оно притягивает электроны и меньше радиус атома.
Какие элементы из третьего периода имеют наибольший радиус атома в своей группе?
Наибольший радиус атома в своей группе имеют щелочные металлы – натрий (Na) и калий (K). У них внешний электрон находится на относительно большом расстоянии от ядра, что делает атомы этих элементов более крупными.
В чем причина уменьшения радиуса атомов от щелочных металлов к галогенам?
При увеличении атомного номера элементов от щелочных металлов к галогенам, количество электронов в атоме увеличивается. При этом, количество энергетических оболочек остается примерно одинаковым. Таким образом, сильнее заряженное ядро притягивает большее количество электронов, сокращая радиус атома. Это приводит к уменьшению радиуса атомов от щелочных металлов к галогенам.
Какие элементы третьего периода имеют наименьший радиус атома в своей группе?
Наименьший радиус атома в своей группе имеют галогены – фтор (F), хлор (Cl), бром (Br) и йод (I). У них внешний электрон находится на относительно малом расстоянии от ядра, что делает атомы этих элементов наименьшими в своей группе.
Какой элемент третьего периода имеет наибольший радиус атома?
Наибольший радиус атома в третьем периоде имеет атом натрия (Na). У натрия внешний электрон находится на наибольшем расстоянии от ядра в периоде, что делает его атом наибольшим по размеру среди элементов этого периода.
