Радиус атомов является одной из основных характеристик химических элементов. Он определяет размер атома и его способность взаимодействовать с другими атомами. В данной статье рассматривается изменение радиуса атомов элементов 3-го периода, прогрессирующее от щелочных металлов к галогенам.
На 3-м периоде расположены элементы натрий, магний, алюминий, кремний, фосфор, сера, хлор и аргон. Щелочные металлы, такие как натрий, характеризуются относительно большим радиусом атомов. Это связано с тем, что в щелочных металлах наружный электрон находится на большом расстоянии от ядра. В результате, атом щелочного металла имеет больший радиус, чем атом галогена, например.
Следующей группой элементов на 3-м периоде являются атомы галогенов. Галогены отличаются от щелочных металлов малым размером радиуса атомов. Это объясняется тем, что в галогенах наружный электрон находится близко к ядру, что делает радиус атома существенно меньше. Такие особенности радиуса атомов галогенов определяют их способность к взаимодействию с щелочными металлами. Процесс передачи электрона от галогена к щелочному металлу происходит легко, благодаря разнице в радиусе атомов.
Изменение радиуса атомов элементов
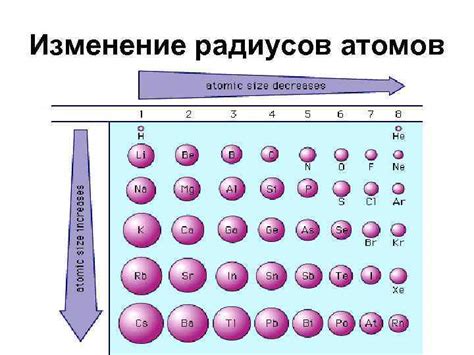
Радиус атома - это величина, характеризующая размер атома. Радиус атома может изменяться в зависимости от его положения в периодической системе и от других факторов. В данном случае рассматривается изменение радиуса атомов элементов 3-го периода от щелочных металлов к галогенам.
Щелочные металлы, такие как литий (Li), натрий (Na) и калий (K), обладают большими атомными радиусами. Это связано с тем, что эти элементы имеют низкую электроотрицательность и отсутствие внутренней оболочки электронов, что позволяет атомам быть относительно большими.
Переходя ко второй половине периода, радиусы атомов начинают уменьшаться. Это происходит из-за увеличения электроотрицательности элементов и присутствия внутренней оболочки электронов. Например, радиусы атомов азота (N), кислорода (O) и фтора (F) меньше, чем у щелочных металлов.
Галогены, такие как хлор (Cl), бром (Br) и йод (I), имеют самые маленькие атомные радиусы в третьем периоде. Они обладают высокой электроотрицательностью и имеют полностью заполненные внутренние оболочки электронов, что делает их атомы очень компактными.
Значения радиусов атомов элементов можно представить в виде таблицы:
| Элемент | Радиус атома (нм) |
|---|---|
| Литий (Li) | 0,152 |
| Натрий (Na) | 0,186 |
| Калий (K) | 0,227 |
| Азот (N) | 0,071 |
| Кислород (O) | 0,066 |
| Фтор (F) | 0,064 |
| Хлор (Cl) | 0,099 |
| Бром (Br) | 0,114 |
| Йод (I) | 0,133 |
Таким образом, можно сказать, что в периоде элементов от щелочных металлов к галогенам происходит уменьшение атомных радиусов. Это связано с увеличением электроотрицательности элементов и изменением строения и расположения электронных оболочек атомов.
Металлы 3-го периода

Металлы 3-го периода включают такие элементы как натрий (Na), магний (Mg), алюминий (Al) и т.д. Эти элементы являются металлами и представляют большую часть периодической системы элементов. Они обладают общими свойствами металлов, такими как жесткость, хорошая теплопроводность и электропроводность.
В отличие от щелочных металлов, металлы 3-го периода обладают более высокой плотностью и высшей температурой плавления. Например, алюминий имеет плотность в 3 раза больше, чем у натрия, и температура плавления около 660 градусов Цельсия.
Магний, алюминий и остальные металлы 3-го периода обладают свойствами активных металлов. Они способны реагировать с кислородом, образуя оксиды и гидроксиды. Также они реагируют с водой, образуя соответствующие оксиды и освобождая водород. Натрий, например, реагирует с водой с выделением водорода и образованием гидроксида натрия.
Кроме того, эти металлы обладают способностью образовывать положительные ионы, вступая в реакции с другими элементами. Например, натрий может образовывать ионы Na+, алюминий - Al3+ и т.д.
Однако, несмотря на некоторую схожесть в свойствах, металлы 3-го периода имеют и отличительные особенности. Например, натрий является щелочным металлом, в то время как алюминий - благородным металлом. Также у этих металлов различается способность к коррозии и реакционная активность.
Галогены 3-го периода
Галогены, входящие в 3-ю группу периодической системы, представлены элементами: хлор, бром и йод. Они относятся к незлаковым элементам и обладают высокой химической активностью. Галогены имеют семь электронов во внешней оболочке и стремятся завершить ее, приобретая восемь электронов.
Хлор является важнейшим галогеном и широко применяется в промышленности и в быту. Он обладает зеленовато-желтым газообразным состоянием при комнатной температуре и может проявлять различные окислительные и обеззараживающие свойства.
Бром является единственным жидким галогеном при комнатной температуре. Он имеет красновато-коричневый оттенок и обладает ярко выраженным антисептическим действием. Бром применяется в фотографии, медицине и химической промышленности.
Йод представляет собой темно-синие блестящие кристаллы. Он применяется в медицине как антисептик и вещество для обнаружения скрытых повреждений на коже.
Галогены 3-го периода химически взаимодействуют с элементами других групп периодической системы, образуя с ними стабильные соединения. Они проявляют высокую электроотрицательность и могут образовывать с другими элементами соли, которые имеют много важных применений в различных областях науки и промышленности.
Сравнение размеров атомов

Размер атома является одной из наиболее важных характеристик элемента. Размер атома определяется радиусом, который показывает расстояние от центра ядра до наружной электронной оболочки. Сравнение размеров атомов элементов 3-го периода от щелочных металлов к галогенам позволяет увидеть систематическую тенденцию.
Наименьший радиус атомов наблюдается у галогенов и наибольший у щелочных металлов. Это связано с тем, что атомы галогенов имеют большую эффективность экранирования ядра от наружной электронной оболочки. Это приводит к увеличению притяжения электронов к ядру и уменьшению размера атома. В то же время, у атомов щелочных металлов имеется всего один электрон в наружной оболочке, что приводит к слабому экранированию ядра и увеличению радиуса атома.
Порядок увеличения размера атомов от щелочных металлов к галогенам можно наблюдать в таблице:
| Щелочные металлы | Атомный радиус (нм) |
|---|---|
| Литий (Li) | 0.152 |
| Натрий (Na) | 0.186 |
| Калий (K) | 0.227 |
| Рубидий (Rb) | 0.248 |
| Цезий (Cs) | 0.265 |
| Франций (Fr) | 0.275 |
Сравнивая данные с радиусами атомов галогенов, можно увидеть, что они значительно меньше. Например, атомный радиус фтора (F) составляет всего 0.064 нм. Это объясняется тем, что атомы галогенов имеют большое количество электронов в наружной оболочке, что повышает притяжение электронов к ядру и уменьшает размер атома.
Таким образом, сравнение размеров атомов элементов 3-го периода позволяет увидеть систематическую тенденцию уменьшения радиуса от щелочных металлов к галогенам. Это объясняется различной эффективностью экранирования ядра и количеством электронов в наружной оболочке.
Факторы, влияющие на радиус атомов
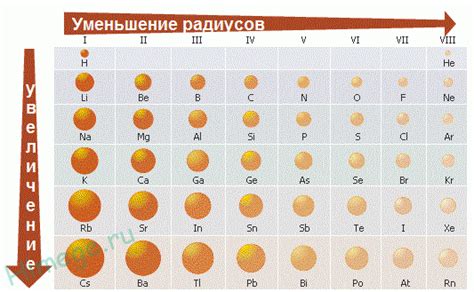
Радиус атомов элементов 3-го периода изменяется от щелочных металлов до галогенов под влиянием нескольких факторов. Один из таких факторов - заряд ядра атома. Чем больше заряд ядра, тем сильнее притяжение электронных облаков, и, следовательно, меньше радиус атома. В периоде от щелочных металлов с однозарядными ионами до галогенов с одноотрицательными ионами заряд ядра увеличивается, что влияет на уменьшение радиуса атомов.
Другим фактором, влияющим на радиус атомов, является количество электронных оболочек. Чем больше оболочек, тем больше будет размер атома. В случае перехода от щелочных металлов с одной электронной оболочкой до галогенов с четырьмя оболочками, радиусы атомов увеличиваются. Это связано с тем, что с увеличением количества оболочек увеличивается вероятность нахождения электронов на большем удалении от ядра, что повышает радиус атома.
Также стоит отметить влияние эффекта экранирования на радиус атомов. Экранирование означает то, что более внутренние электроны между ядром и внешними электронами создают 'экранирующий' эффект, уменьшая притяжение внешних электронов к ядру. В случае периода от щелочных металлов до галогенов, количество внутренних электронов увеличивается, что приводит к усилению экранирования и увеличению радиуса атомов.
Следует отметить, что эти факторы являются взаимосвязанными, и их комбинированное влияние определяет изменение радиуса атомов элементов 3-го периода от щелочных металлов к галогенам.
Тенденции изменения радиуса

Изучение изменения радиуса атомов элементов 3-го периода от щелочных металлов к галогенам позволяет увидеть определенные тенденции и закономерности. Эти изменения связаны с изменением зарядового состояния ядра атома и числа электронных оболочек. Радиус атома совокупность и размеров его электронных оболочек.
В периоде щелочных металлов (натрий, калий) радиус атомов увеличивается от лития к калию. Это связано с увеличением зарядового состояния ядра атома: у лития заряд ядра составляет +3, а у калия уже +19. Увеличение зарядового состояния ядра приводит к более сильному притяжению электронных оболочек к ядру, что уменьшает радиус атома.
В периоде галогенов (фтор, хлор) происходит обратное изменение радиуса атомов. Радиус атомов галогенов увеличивается от фтора к йоду. Это связано с увеличением числа электронных оболочек у атомов: у фтора 2 электронные оболочки, а у йода уже 5. Увеличение числа электронных оболочек приводит к увеличению взаимного отталкивания электронов и расширению радиуса атома.
Все эти изменения радиуса атомов связаны с изменением электронной структуры атомов и их свойств. Понимание этих тенденции позволяет более точно определить химические свойства элементов и их реакционную способность.
Радиусы веществ в периоде
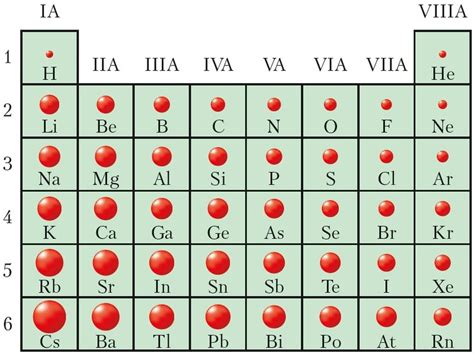
В периоде, начиная с щелочных металлов и заканчивая галогенами, радиус атомов элементов изменяется в определенном порядке. Это является следствием электронной конфигурации и структуры атомов этих элементов.
Радиусы атомов щелочных металлов, таких как литий (Li), натрий (Na) и калий (K), варьируются от наименьшего радиуса у лития до наибольшего радиуса у калия. Это связано с увеличением числа электронных оболочек, что приводит к увеличению атомного радиуса. Калий имеет больше электронных оболочек, чем литий, поэтому его атомный радиус наибольший.
Радиусы атомов переходных элементов в этом периоде, таких как титан (Ti) и хром (Cr), находятся между радиусами щелочных металлов и галогенов. Они имеют большую электронную конфигурацию, которая может быть связана с несколькими электронными оболочками, что приводит к увеличению атомного радиуса по сравнению с щелочными металлами.
Радиусы атомов галогенов, такие как хлор (Cl), бром (Br) и йод (I), увеличиваются в периоде, начиная с наименьшего радиуса у хлора до наибольшего радиуса у йода. Это связано с увеличением числа электронов во внешней электронной оболочке, что приводит к увеличению атомного радиуса.
Таким образом, радиусы веществ в периоде изменяются в определенной последовательности, которая зависит от электронной конфигурации и структуры атомов элементов. Щелочные металлы имеют наименьшие радиусы, галогены имеют наибольшие радиусы, а переходные элементы находятся между ними.
Вопрос-ответ

Почему радиус атомов элементов 3-го периода увеличивается от щелочных металлов к галогенам?
Радиус атома определяется электронной структурой атома. Как мы знаем, в атоме число электронов растет от щелочных металлов к галогенам. При этом, увеличивается количество электронных оболочек, что ведет к увеличению размера атома.
Какие факторы влияют на изменение радиуса атомов элементов 3-го периода?
На изменение радиуса атомов элементов 3-го периода влияет несколько факторов. Основными из них являются электронная структура атомов и количество электронных оболочек. Также, на радиус атома могут влиять и другие факторы, такие как электронная связь и заряд ядра.
Как изменяется заряд ядра атома от щелочных металлов к галогенам?
Заряд ядра атома определяется числом протонов в нем. У галогенов, в отличие от щелочных металлов, число протонов в ядре увеличивается. Следовательно, заряд ядра галогенов будет больше по сравнению с щелочными металлами.
Как изменяется электронная структура атомов элементов 3-го периода от щелочных металлов к галогенам?
Электронная структура атомов элементов 3-го периода изменяется от щелочных металлов к галогенам. У щелочных металлов внешний электронный слой содержит 1 электрон, тогда как у галогенов - 7 электронов. Таким образом, галогены имеют более сложную электронную структуру по сравнению с щелочными металлами.
В чем заключается связь между изменением радиуса атомов и их химическими свойствами?
Изменение радиуса атомов влияет на их химические свойства. Большие атомы, такие как щелочные металлы, имеют слабые притяжения с окружающими атомами и могут легко отдавать электроны. В то же время, маленькие атомы, такие как галогены, имеют сильные притяжения с окружающими атомами и могут легко принимать электроны. Именно эта разница в свойствах атомов определяет их химическое поведение.
