Галогены – это химические элементы, относящиеся к группе 17 (в актуальной системе нумерации) или VIIA (в старой системе нумерации) периодической таблицы Менделеева. Они включают фтор, хлор, бром, йод и астат. Однако не всем известно, что в этой группе также находится редкий металл, который пользуется особой известностью – радиоактивный галоген.
Радиоактивный галоген, известный также как элемент 117 и временно названный "тербий", является искусственным элементом, полученным в лабораторных условиях. Он был впервые синтезирован в 2010 году совместными усилиями российских и американских ученых. Радиоактивный галоген характеризуется особыми свойствами, которые привлекают внимание и научных исследователей, и обычных людей.
"Радиоактивный галоген - это элемент, который можно найти только в экстремальных условиях, например, в частицевых ускорителях. Он обладает необычными электрохимическими свойствами и является одним из самых нестабильных и короткоживущих элементов в периодической системе. Тем не менее, его радиоактивность и уникальные характеристики делают его неотъемлемым элементом для исследований в области физики и химии", - отмечают ученые.
Происхождение и обнаружение галогена

Галогены - это группа химических элементов, включающая фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At). Термин "галогены" происходит от греческого слова "halos", что означает "соль", и "gennan", что означает "порождать". Галогены обладают высокой реактивностью и способностью к образованию солей, что объясняет их название.
Первоначально открытие галогенов было связано с исследованием свойств минеральных солей и морской воды. Фламандский алхимик Антониус ван Левенгук в 1670 году описал характерные свойства морской соли, а немецкий химик Мартин Хоштейн в 1811 году экспериментально доказал наличие нового элемента - йода, вводя его в химическую номенклатуру.
Изначально известные галогены - хлор, бром и йод - были открыты в природе, однако фтор и астат были обнаружены позже в ходе лабораторных исследований. Их открытие позволило более полно изучить свойства этой группы элементов и их взаимодействие с другими веществами.
Сегодня галогены широко используются в различных областях, включая химическую промышленность, фармацевтику, электронику и др. Изучение их свойств и реакций позволяет улучшить многие технологические процессы и разработать новые материалы с уникальными свойствами.
Физические свойства галогена

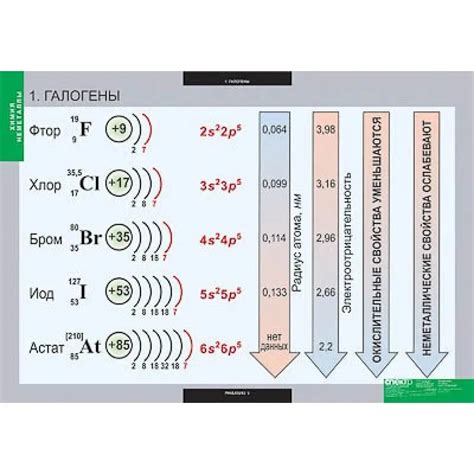
1. Агрегатное состояние: галогены — это элементы, которые в стандартных условиях обычно находятся в виде двухатомных молекул. Фтор и хлор представляют собой газы, бром — жидкость, а йод — твёрдое вещество.
2. Температура плавления и кипения: у галогенов эти значения резко возрастают с увеличением атомного номера в периоде. Температура плавления и кипения фтора самая низкая, брома — средняя, а йода — самая высокая среди галогенов.
3. Цвет: галогены обладают яркими цветами. Фтор и хлор имеют желто-зеленую окраску, бром — красный, а йод — темнофиолетовый.
4. Растворимость: галогены хорошо растворяются в органических растворителях, таких как ацетон и этиловый спирт. Они также растворяются в воде и взаимодействуют с ней, образуя галогенидные и уксуснокислые кислоты.
5. Активность: галогены являются очень активными элементами и обладают сильным окислительным действием. Они способны взаимодействовать с большинством металлов, образуя с ними соли, которые называются галогенидами.
6. Токсичность: галогены могут быть опасны для жизни. В частности, хлор и бром в высоких концентрациях могут вызывать серьезные ожоги кожи и повреждения дыхательных путей.
7. Электронный строение: у атомов галогенов внешний электронный слой содержит 7 электронов, что делает их очень реактивными и способными к образованию ковалентных связей с другими элементами.
В целом, физические свойства галогенов делают их уникальными элементами с широким спектром применений и значительным влиянием на химические и физические процессы в природе и технологии.
Химические свойства галогенов

Галогены - это группа химических элементов, включающая фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At). Они отличаются высокой электроотрицательностью и образуют сильные электрохимические связи.
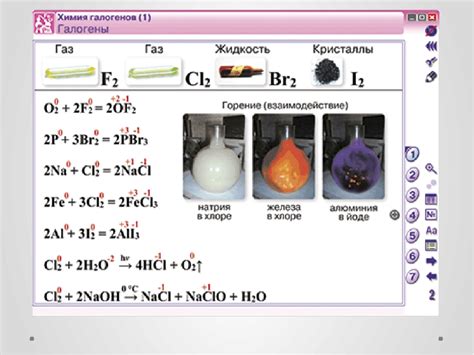
Галогены обладают одним общим свойством - они формируют соль, когда реагируют с металлами. Например, хлор реагирует с натрием, образуя натрий хлорид (NaCl), который является основным компонентом поваренной соли. Интересно отметить, что галогены также образуют соли с некоторыми неметаллическими элементами, такими как водород или кислород.
Галогены также известны своими окислительными свойствами. Они способны получать электроны от других элементов, что делает их сильными окислителями. Например, фтор способен окислять многие металлы, включая железо. При этом образуется металлический фторид.
Еще одним химическим свойством галогенов является их способность образовывать кислоты. Например, хлор формирует хлороводородную кислоту (HCl), а фтор образует фтороводородную кислоту (HF).
Также следует отметить, что галогены являются самыми реактивными элементами из всех неметаллов. Они могут реагировать с большим количеством других элементов и соединений, создавая разнообразные химические реакции.
Влияние галогенов на окружающую среду

Галогены, такие как хлор, фтор, бром и йод, играют важную роль в окружающей среде. Они широко используются в различных отраслях промышленности, включая производство пластиков, растворителей, искусственных удобрений и медикаментов. Однако неконтролируемое использование галогенов может иметь негативное влияние на экосистемы и здоровье человека.
Одним из основных экологических проблем, связанных с галогенами, является их высокая устойчивость и токсичность. Галогены могут накапливаться в природных водоемах, почве и живых организмах, таких как рыбы и растения.
Кроме того, некоторые галогены, такие как фтор и хлор, могут быть выброшены в атмосферу при сгорании отходов и производственных отходов, что приводит к загрязнению воздуха и кислотным дождям. Накопление этих веществ в атмосфере может также вызывать проблемы с озоновым слоем Земли и увеличение уровня ультрафиолетового излучения.
Для снижения негативного влияния галогенов на окружающую среду, необходимо разработать более экологически безопасные методы и материалы. Усилия также должны быть направлены на контроль и мониторинг выбросов галогенов в окружающую среду, а также на поощрение и применение возобновляемых источников энергии.
В целом, понимание влияния галогенов на окружающую среду и принятие мер для минимизации их отрицательных последствий являются важными шагами в направлении устойчивого развития и сохранения природы для будущих поколений.
Радиоактивные свойства галогена
Галогены - это группа химических элементов, которые обладают выраженными радиоактивными свойствами. Они являются атомными электронными донорами и образуют ковалентные связи. Галогены включают фтор (F), хлор (Cl), бром (Br), иод (I) и астат (At), причем последний является самым редким и тяжелым.
Одно из ключевых свойств галогенов - их способность к радиоактивному распаду. Они обладают нестабильными ядрами и могут излучать радиацию. При радиоактивном распаде галогенов образуются другие элементы, что позволяет использовать их в различных радиоактивных исследованиях.
Кроме того, радиоактивные галогены являются важным инструментом в медицине. Их способность аккумулироваться в определенных органах или тканях позволяет использовать их для диагностики и лечения различных заболеваний. Например, радиоактивный йод используется в лечении заболеваний щитовидной железы.
Также галогены обладают антисептическими свойствами и активно применяются в процессе очистки воды и воздуха. Их способность уничтожать бактерии и вирусы делает их очень полезными в медицине и санитарии.
Применение галогена в научных исследованиях

Галогены, включая радиоактивный галоген, широко применяются в научных исследованиях благодаря своим уникальным свойствам и химическим реакциям. Эти элементы играют важную роль в различных областях, таких как физика, химия, биология и медицина.
Физические исследования: Галогены используются в физических исследованиях для изучения свойств атомных ядер и элементарных частиц. Радиоактивный галоген помогает ученым изучить особенности взаимодействия частиц и процессов радиоактивного распада. Эта информация может иметь важное значение для разработки новых методов детектирования и лечения раковых опухолей.
Химические исследования: Галогены являются ценными инструментами в химических исследованиях. Их высокая реакционная активность позволяет ученым изучать различные химические реакции и создавать новые соединения. Благодаря своей высокой электроотрицательности, галогены могут образовывать стабильные связи с другими элементами, такими как металлы, что делает их незаменимыми в химическом анализе и синтезе.
Биологические исследования: Галогены также играют важную роль в биологических исследованиях. Многие биологически активные вещества содержат атомы галогенов в своей структуре. Изучение реакций и взаимодействия галогенов внутри живых организмов позволяет ученым понять их эффекты на здоровье человека и животных. Кроме того, галогены могут использоваться в маркировке исследуемых биомолекул и в диагностике заболеваний.
Таким образом, применение галогена в научных исследованиях позволяет ученым расширить границы наших знаний о материи, реакциях и взаимодействии различных составляющих мира. Это помогает развитию науки и технологий, а также находит практическое применение в медицине и других областях.
Техническое использование галогена
Галогены в химии являются очень активными элементами, что делает их полезными в различных технических приложениях. Одним из основных способов использования галогена является его применение в процессе синтеза органических соединений.
Галогены также используются для создания специальных отбеливающих и отбеливающих смесей, которые широко применяются в текстильной и бумажной промышленности. Они также используются в процессе обработки воды для удаления вредных микроорганизмов и улучшения качества воды.
Радиоактивный галоген может использоваться в ядерной энергетике при производстве ядерного топлива. Также изотопы галогенов используются в медицине для диагностики и лечения различных заболеваний.
Некоторые галогены могут быть использованы в процессе производства полупроводников, что делает их необходимыми материалами для электронной промышленности. Они также могут быть использованы в процессе создания стекла и керамики.
Учитывая их высокую активность, галогены требуют специальных условий хранения и обработки. Они должны быть использованы с осторожностью, чтобы избежать возможного взаимодействия с другими химическими веществами и негативного воздействия на окружающую среду и здоровье человека.
Перспективы использования галогена в будущем

Галоген, как редкий металл, имеет множество потенциальных перспектив в различных сферах применения. Одной из наиболее перспективных областей использования галогена является энергетика. Благодаря высокой радиоактивности, галоген может служить источником энергии в ядерных реакторах. Его использование может значительно увеличить эффективность процессов производства электроэнергии и способствовать разработке новых технологий в этой области.
Еще одной перспективной областью использования галогена является медицина. Благодаря своим радиоактивным свойствам, галоген может использоваться для лечения определенных видов рака и других заболеваний. Например, он может быть использован в качестве радиоактивного индикатора при диагностировании опухолей и контроле их роста.
Галоген также может найти применение в промышленности. Он может быть использован в процессах очистки и дезинфекции воды и воздуха. Благодаря своим антимикробным свойствам, галоген может стать эффективным средством борьбы с бактериями и грибками в различных промышленных процессах.
Более широкое использование галогена возможно и в других областях, таких как сельское хозяйство, материаловедение и электроника. Современные исследования и разработки позволяют нам раскрыть все больше потенциала этого редкого металла и находить новые способы его использования в различных отраслях науки и промышленности.
Вопрос-ответ

Чем отличается радиоактивный галоген от обычного галогена?
Радиоактивный галоген — это галогенный элемент, который обладает радиоактивными свойствами. В отличие от обычных галогенов, радиоактивный галоген подвержен ядерному распаду и излучает радиацию.
Какие свойства имеет радиоактивный галоген?
Радиоактивный галоген обладает как обычными галогенными свойствами, так и радиоактивными свойствами. Он может вступать в химические реакции с другими веществами, образуя с ними соединения, и одновременно излучает радиацию.
