Щелочные металлы - это группа элементов, которые относятся к первой группе периодической системы химических элементов. В это группу входят литий, натрий, калий, рубидий, цезий и франций. Щелочные металлы обладают рядом особенных свойств, которые делают их уникальными в мире химии.
Простые вещества щелочных металлов обладают высокой реакционной способностью, особенно с водой и воздухом. Они растворяются в воде, образуя щелочные растворы, которые обладают высоким pH. В результате реакции с водой щелочные металлы выделяются водород и образуют гидроксиды. Кроме того, эти металлы могут гореть на воздухе и реагировать с кислородом, образуя оксиды.
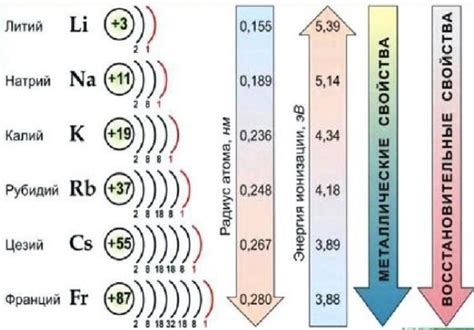
Связь между щелочными металлами заключается в их общих химических свойствах и схожем строении электронной оболочки. Они имеют одну внешнюю электронную оболочку с одним электроном, что делает их очень реакционно-способными. Кроме того, щелочные металлы обладают низкой электроотрицательностью и низким температурным плавлением, что делает их хорошими проводниками электричества и жидкими при комнатной температуре.
В целом, щелочные металлы играют важную роль в химической промышленности, обладая множеством полезных свойств и применений. Они используются в производстве щелочей, щелочных батарей, сплавов с другими металлами и даже в медицине. Изучение свойств и взаимодействий щелочных металлов позволяет развивать новые технологии и улучшать существующие процессы.
Щелочные металлы и их взаимосвязь
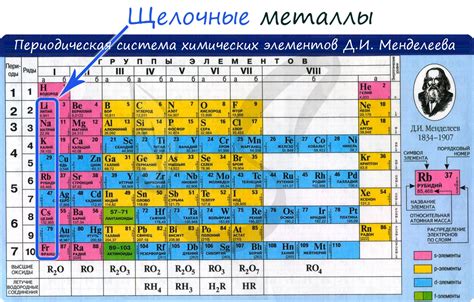
Щелочные металлы представляют собой группу элементов периодической таблицы, которая включает в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают сходными химическими свойствами и являются самыми реактивными из всех химических элементов. Хотя они имеют разные химические свойства, все щелочные металлы имеют один электрон во внешней энергетической оболочке, что делает их очень реактивными в химических реакциях.
Взаимосвязь между щелочными металлами основана на их химических свойствах и реактивности. Они образуют сильные щелочные растворы, которые могут растворять множество веществ, включая металлы и неметаллы. Они также образуют ионы щелочных металлов, которые обладают положительным зарядом и играют важную роль во многих химических реакциях.
Каждый щелочный металл имеет свои особенности и уникальные свойства. Например, литий является самым легким из всех щелочных металлов и обладает высокой реактивностью. Натрий является одной из основных составляющих поваренной соли и имеет большое промышленное значение. Калий является необходимым элементом для живых организмов и является основным компонентом удобрений. Рубидий и цезий также имеют свои применения в различных областях науки и промышленности.
Взаимосвязь щелочных металлов проявляется во многих химических реакциях и синтезе различных соединений. Они могут образовывать соли с различными кислотами и реагировать с водой, кислородом и другими веществами. Более того, они могут образовывать сплавы с другими металлами, что расширяет их применение в инженерии и производстве.
В целом, щелочные металлы обладают сходными свойствами, но имеют уникальные особенности, которые делают их полезными в различных областях науки, технологии и промышленности. Изучение их взаимосвязи помогает лучше понять особенности химических реакций и процессов, в которых они участвуют.
Свойства щелочных металлов

1. Металлические свойства: Щелочные металлы являются мягкими, легкоплавкими и хорошо проводящими тепло и электричество элементами. Они обладают металлическим блеском и хорошо податливы.
2. Активность: Щелочные металлы очень активны химически. Они легко реагируют с водой и кислородом из воздуха, образуя щелочи и окислы соответственно. Их активность увеличивается по мере движения вниз по группе периодической системы.
3. Летучесть: Некоторые щелочные металлы, такие как литий и натрий, обладают высокой летучестью и могут испаряться при комнатной температуре.
4. Способность образовывать ионы: Щелочные металлы имеют одновалентный ионный радиус, что делает их способными образовывать положительно заряженные ионы Щелочные металлы, такие как литий, натрий и калий, образуют стабильные iоны посредством отдачи одного электрона.
5. Окрашивание пламени: Щелочные металлы могут окрашивать пламя в яркие цвета. Например, литий окрашивает пламя в красный цвет, натрий - в желтый, а калий - в фиолетовый.
6. Связь между щелочными металлами: Щелочные металлы образуют решетчатые кристаллические структуры, где каждый металл связан с окружающими его атомами. Именно эта связь между атомами обеспечивает уникальные свойства щелочных металлов.
Структура и взаимодействие щелочных металлов
Структура щелочных металлов представляет собой кристаллическую решетку, в которой каждый атом окружен шестью или восемью соседними атомами. Эта структура обуславливает металлические свойства щелочных металлов, такие как хорошая электропроводность и пластичность.
Взаимодействие щелочных металлов со средой определяется их химической активностью. Щелочные металлы легко реагируют с водой, образуя гидроксиды и выделяя водород. Они также реагируют с кислородом, образуя оксиды. Кроме того, щелочные металлы реагируют с кислотами и многими другими веществами, образуя соли.
Щелочные металлы обладают высокой способностью образовывать ионы, поэтому они часто используются в различных химических реакциях. Ионные соединения щелочных металлов широко применяются в промышленности, медицине и научных исследованиях. Они используются как катализаторы в различных процессах, а также в производстве стекла, мыла и других продуктов.
Свойства щелочных металлов и их взаимодействие с другими веществами делают их важными элементами в различных областях науки и технологии. Изучение структуры и химических свойств щелочных металлов позволяет разрабатывать новые материалы и улучшать существующие технологии.
Вопрос-ответ

Какие элементы относятся к щелочным металлам?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
В чем состоит особенность щелочных металлов?
Особенностью щелочных металлов является их высокая реактивность, низкая плотность и низкая температура плавления.
Каким образом щелочные металлы связаны между собой?
Щелочные металлы связаны между собой с помощью общих свойств и химических реакций. Они имеют одинаковую электронную структуру, что делает их химически похожими.
Какие свойства металлов делают их щелочными?
Щелочные металлы обладают низкой электроотрицательностью, малой ионизационной энергией и большими радиусами атомов, что позволяет им легко отдавать электроны и образовывать положительные ионы.
В каких областях находят применение щелочные металлы?
Щелочные металлы находят применение в различных областях, таких как производство стекла, фармацевтика, электропроводность, аккумуляторы, ядерная энергетика и другие.
