Металлы и неметаллы - это две основные группы химических элементов, которые играют важную роль в нашей жизни. Металлы обладают такими свойствами, как высокая теплопроводность, электропроводность и гибкость. Они имеют твердое состояние при комнатной температуре и блестящую поверхность. Неметаллы, напротив, обычно не обладают электропроводностью и имеют непроводящую поверхность.
Металлы широко используются в различных отраслях промышленности и строительства. Они являются основными материалами для производства автомобилей, самолетов, бытовой техники и других предметов. Самые популярные металлы - железо, алюминий, медь и свинец.
Неметаллы, в свою очередь, играют важную роль в химической и фармацевтической промышленности. Они используются для создания различных химических соединений и лекарственных препаратов. Неметаллы включают в себя элементы, такие как кислород, азот, углерод и фосфор.
Оксиды - это соединения, которые образуются при соединении металлов или неметаллов с кислородом. Они широко распространены в природе и являются основными компонентами горных пород и почвы. Оксиды также используются в промышленности для производства стекла, керамики и различных видов покрытий.
Металлы и их свойства

Металлы – это химические элементы с характерными свойствами: высокой теплопроводностью, электропроводностью и пластичностью. Они имеют металлический блеск и способны приобретать высокую механическую прочность.
У металлов имеется специфическое связующее между их атомами – металлическая связь, которая обусловливает их основные свойства и химическую активность.
Металлы обладают высокой плотностью и могут быть представлены в различных формах, таких как проволока, листы, стержни и т.д. Они отличаются химической стойкостью и устойчивостью к коррозии.
Металлы используются в различных отраслях промышленности, таких как машиностроение, электротехника, строительство и другие. Некоторые металлы, такие как железо, алюминий, медь и золото, являются основными материалами для производства различных изделий.
- Металлы являются хорошими проводниками тепла и электричества, благодаря чему находят широкое применение в электротехнике.
- Они обладают высокой механической прочностью, поэтому металлические конструкции обладают стабильностью и надежностью.
- Металлы можно обрабатывать различными способами, такими как литье, ковка, штамповка, сверление и т.д., что позволяет получать изделия с разной формой и размером.
Металлическая структура и электрическая проводимость
Металлы – это материалы с особым типом кристаллической структуры, которая обладает высоким уровнем упорядоченности. Кристаллическая структура металлов характеризуется наличием регулярной сетки атомов, называемой решеткой. Внутри этой решетки атомы металла тесно упакованы и сильно связаны друг с другом.
Металлическая структура обеспечивает металлам основные свойства – прочность и деформируемость. Их атомы способны перемещаться друг относительно друга без значительного нарушения связей между ними. Это означает, что металлы могут быть легко прокатаны, вытянуты или изготовлены в различные формы.
Другой важной характеристикой металлов является их высокая электрическая проводимость. В металлической структуре атомы находятся достаточно близко друг к другу, что позволяет электронам свободно двигаться и переносить электрический заряд. Поэтому металлы являются эффективными проводниками электричества.
Металлический блеск и способность к обработке

Металлы являются особым классом веществ, которые обладают рядом уникальных свойств. Одним из таких свойств является металлический блеск. Он проявляется в том, что поверхность металла отражает свет, создавая впечатление, что она сверкает. Этот блеск делает металлы привлекательными для использования в декоративных изделиях и украшениях.
Кроме того, металлы обладают высокой прочностью и способностью к обработке. Они легко поддаются формированию и могут быть прокатаны, вытянуты, изготовлены в разные формы. Прочность металлов позволяет им выдерживать большие механические нагрузки без деформации или разрушения.
Металлы также хорошо проводят электрический ток и тепло. Их электропроводность и теплопроводность делают металлы незаменимыми в промышленности и энергетике. Они используются для создания электрических проводов, теплообменников, радиаторов и других устройств, которые требуют высокой теплопроводности и электропроводности.
Кроме того, металлы можно сваривать и паять. Это позволяет соединять металлические детали между собой, создавая прочные и устойчивые соединения. Сварка и пайка позволяют создавать сложные конструкции и изделия из металла, которые могут быть использованы в различных отраслях промышленности и строительства.
Неметаллы и их особенности

Неметаллы - это группа химических элементов, которые обладают несколькими общими особенностями. В отличие от металлов, неметаллы обычно не обладают блеском и электропроводностью. Они имеют низкую плотность и хрупкую структуру.
Неметаллы обычно образуют ковалентные соединения, в которых электроны общуются, образуя сильные химические связи. Большинство неметаллов являются немагнитными, некоторые из них не обладают термической электропроводностью.
Один из самых известных неметаллов - кислород. Он является важным компонентом воздуха и играет существенную роль в обмене веществ у живых организмов. Однако, есть и другие неметаллы, такие как водород, азот, фосфор, сера и хлор, которые также имеют широкое применение в различных отраслях науки и промышленности.
Неметаллы могут образовывать оксиды - химические соединения, состоящие из неметалла и кислорода. Оксиды неметаллов обычно обладают кислотными свойствами и реагируют с водой, образуя кислоты. Например, из серы и кислорода образуется сернистая кислота.
Таким образом, неметаллы представляют собой важную группу элементов, которые играют ключевую роль в химии и науке в целом. Изучение неметаллов позволяет более полно понять их свойства и применение в различных сферах жизни.
Ковалентная связь и непроводимость
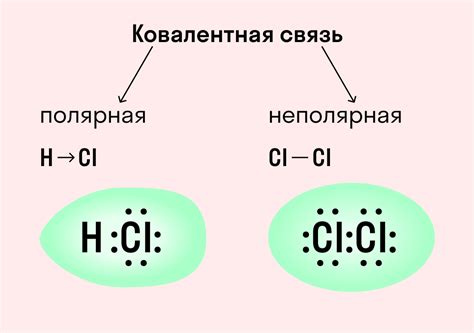
Ковалентная связь - это тип химической связи, который образуется между атомами неметаллов. В ходе ковалентной связи электроны внешней оболочки атома распределяются между двумя атомами, образуя общую пару электронов. Наличие общей пары электронов в ковалентной связи делает ее очень крепкой и стабильной.
Неметаллы обладают высокой электроотрицательностью, что приводит к тому, что электроны в общих парах в ковалентных связях смещены ближе к атому с более высокой электроотрицательностью. Такое смещение электронов в ковалентной связи создает полярность молекулы неметалла.
Молекулы неметаллов, связанные ковалентной связью, обладают низкой проводимостью. Такая непроводимость обусловлена тем, что общие пары электронов в ковалентной связи заключены между двумя атомами и не могут свободно перемещаться по молекуле. Таким образом, неметаллы не являются электропроводниками.
Кроме того, оксиды неметаллов, образованные ковалентными связями, также обладают непроводимостью. В оксидах неметаллов электроны в общих парах связаны с атомами неметалла и не могут свободно перемещаться по кристаллической решетке оксида. Это делает оксиды неметаллов плохими электропроводниками.
Химическая активность и газообразное состояние
Химическая активность различных веществ определяется их способностью взаимодействовать с другими веществами. Важно отметить, что металлы и неметаллы обладают различной химической активностью.
Металлы, в основном, проявляют свою активность в реакциях с кислородом, ненасыщенными соединениями и галогенами. Они обладают низкой электроотрицательностью и, как правило, образуют ионные соединения, восстанавливаясь в реакциях окисления.
Неметаллы, напротив, проявляют свою активность в реакциях с металлами, особенно с щелочными и щелочно-земельными металлами. Они обладают высокой электроотрицательностью и обычно образуют ковалентные или ионно-ковалентные соединения, окисление таких веществ происходит довольно сложно.
Газообразное состояние веществ, включая металлы, неметаллы и оксиды, обусловлено их физическими и химическими свойствами. Некоторые металлы, такие как магний и цинк, при нагревании легко испаряются и образуют газообразные соединения.
Некоторые неметаллы, например, хлор и фтор, также могут существовать в виде газов при комнатной температуре и атмосферном давлении. Оксиды, в зависимости от состава и условий окружающей среды, могут быть как газообразными, так и твердыми веществами.
Таким образом, химическая активность веществ, а также их газообразное состояние, зависят от их химических и физических свойств, определяющих их поведение в реакциях и в различных условиях.
Оксиды и их роль в природе

Оксиды — это химические соединения, состоящие из кислорода и другого химического элемента. В природе оксиды широко распространены и имеют важное значение. Они играют роль в различных геологических процессах и являются неотъемлемой частью жизни на Земле.
Одним из наиболее известных оксидов является оксид железа (Fe2O3), который называется также оксидом железа(III) или оксидом октра. Этот минерал называется гематитом и широко встречается в природе. Гематит используется в производстве стали и является ценным сырьем для промышленности.
Оксиды также играют важную роль в процессах окисления и восстановления. Они участвуют в химических реакциях, которые происходят в природе, таких как сжигание и гниение органических веществ. Благодаря оксидам, происходит выделение энергии в виде тепла и света.
Одним из наиболее распространенных оксидов в атмосфере является углекислый газ (СО2). Этот газ играет важную роль в регулировании температуры на Земле и является одним из главных газов в парниковом эффекте. Углекислый газ также участвует в фотосинтезе растений и является одним из главных источников углерода для живых организмов.
Оксиды также используются в производстве различных материалов. Например, оксид алюминия (Al2O3), известный как алюминий, является одним из наиболее распространенных металлов и используется во многих отраслях промышленности, таких как авиация, строительство, электроника и многие другие.
Таким образом, оксиды являются важными химическими соединениями, которые широко распространены в природе и играют важную роль в различных процессах. Они обеспечивают жизненно важные химические реакции, участвуют в формировании материалов и воздействуют на климатические процессы на Земле.
Щелочные оксиды и щелочные гидроксиды

Щелочные оксиды - это химические соединения, которые образуются при сочетании щелочных металлов с кислородом. Они обладают щелочными свойствами и реагируют с водой, образуя соответствующие гидроксиды.
Главными представителями щелочных оксидов являются оксид натрия (Na2O) и оксид калия (K2O). Они оба обладают высокой растворимостью в воде и образуют сильные щелочные растворы, которые в химии называют гидроксидами.
Щелочные гидроксиды - это основные вещества, которые образуются при реакции щелочных оксидов с водой. Гидроксид натрия (NaOH) и гидроксид калия (KOH) являются наиболее распространенными бытовыми и промышленными щелочными растворами.
Гидроксиды щелочных металлов обладают высокими pH значениями и широко используются в различных отраслях промышленности. Они являются необходимыми компонентами для производства стекла, мыла, моющих средств, дезинфицирующих растворов и других химических продуктов. Кроме того, гидроксиды натрия и калия применяются в процессах очистки и регулирования pH в водных системах.
Кислотные оксиды и соли
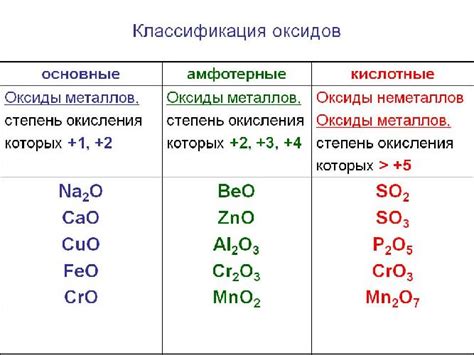
Кислотные оксиды - это химические соединения, образующиеся при реакции металла, полуметалла или неметалла с кислородом. Они называются "кислотными" из-за своей способности образовывать кислоты при контакте с водой.
Кислотные оксиды обладают кислотными свойствами и реагируют с основаниями, образуя соли и воду. Например, оксид серы (IV) (СO2) реагирует с гидроксидом натрия (NaOH), образуя соль натрий сернокислой (Na2SO3) и воду:
CO2 + 2NaOH = Na2SO3 + H2O
Соли, в свою очередь, представляют собой химические соединения, в которых неметалл или группа неметаллов замещает один или несколько атомов водорода в кислоте. Они образуются при реакции кислоты с основанием. Например, в результате реакции соляной кислоты (HCl) с гидроксидом натрия (NaOH) образуется соль – хлорид натрия (NaCl) и вода:
HCl + NaOH = NaCl + H2O
Кислотные оксиды и соли широко применяются в различных сферах жизни, включая производство удобрений, стекла, керамики, а также в процессе очистки и обработки воды.
Вопрос-ответ

Какие основные свойства металлов?
Металлы обладают следующими основными свойствами: высокой теплопроводностью и электропроводностью, пластичностью и деформируемостью, блеском и определенной твердостью.
Что такое неметаллы?
Неметаллы – это элементы, которые обладают низкой теплопроводностью и электропроводностью, неметаллическим блеском и хрупкостью. Они образуют нековкие, твердые или газообразные вещества, легко образуют соединения с металлами.
