Реакция металлов с серной кислотой является одной из наиболее широко используемых реакций в химической лаборатории. При этой реакции образуются сульфаты металлов и выделяется водород. Серная кислота (H2SO4) разлагается на ионы H+ и SO42- при контакте с металлами.
Обычно для этой реакции используются металлы активной серии, такие как цинк (Zn), железо (Fe), алюминий (Al) и магний (Mg). Концентрированная серная кислота обладает достаточно сильной окислительной способностью, поэтому она может реагировать с этими металлами и высвобождать водород.
Реакция происходит следующим образом: металл обладает электронной оболочкой с валентными электронами, которые отдают свои электроны атомам водорода. В результате образуется гидроксид металла и свободные электроны, которые затем реагируют с ионами H+ серной кислоты, образуя молекулы водорода. Водород выделяется в виде пузырьков газа, а серная кислота превращается в сульфат металла.
Реакция металлов с концентрированной серной кислотой сопровождается значительным выделением тепла и образованием белого дыма серной кислоты. При этом необходимо соблюдать осторожность, так как реакция происходит с выделением горячих газов и может привести к опасным последствиям. Поэтому реакцию следует проводить только в химической лаборатории под надлежащим контролем и с соблюдением всех мер предосторожности.
Реакция концентрированной серной кислоты с металлами: понимание процесса

Реакция концентрированной серной кислоты с металлами – это процесс, который приводит к образованию солей и отдельних продуктов реакции. Понимание этого процесса является важным для изучения химических свойств и возможностей использования серной кислоты в различных химических реакциях.
При проведении реакции концентрированной серной кислоты с металлами происходит образование соли серной кислоты и выделение водорода. Металлы, обладающие высокой реакционной активностью, такие как цинк, железо или алюминий, реагируют с серной кислотой, освобождая молекулы водорода и образуя соли. Данная реакция сопровождается эволюцией газа и выделением тепла.
Важно учитывать, что для успешного протекания реакции металл должен обладать достаточной реакционной активностью, чтобы соревноваться с серной кислотой за водород и создать условия для образования соли. При этом металл должен быть достаточно чистым и не содержать примесей, которые могут изменять ход реакции или затормозить ее.
Изучение реакции концентрированной серной кислоты с металлами позволяет лучше понять и описать принципы химических реакций, их кинетику и важность факторов, влияющих на образование солей и других продуктов реакции. Понимание этой реакции и ее механизма может быть использовано для разработки новых технологий и процессов в различных отраслях промышленности.
Продукты взаимодействия металлов с концентрированной серной кислотой
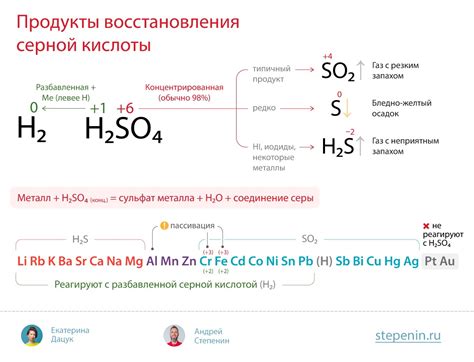
Взаимодействие металлов с концентрированной серной кислотой является химической реакцией, в результате которой образуются продукты этого взаимодействия. Оно основано на окислении металла и выделении молекулы серной кислоты.
Сульфаты металлов являются основным продуктом взаимодействия металлов с концентрированной серной кислотой. Сульфаты образуются благодаря замещению водорода в молекуле серной кислоты металлом. При этом металл окисляется до положительного иона, а серная кислота восстанавливается до сернистой кислоты.
Важно отметить, что скорость реакции металла с концентрированной серной кислотой зависит от его активности. Более реакционными металлами, такими как натрий или калий, реакция протекает быстрее, в то время как менее реакционные металлы, например, железо, реагируют медленнее.
При проведении эксперимента можно наблюдать эффекты, связанные с образованием продуктов реакции. Например, в результате взаимодействия цинка с концентрированной серной кислотой образуется серно-ватистый цвет, характерный для сульфидных соединений. Также можно заметить выделение газа, обычно это пары сероводорода, который имеет характерный запах гнилых яиц.
Взаимодействие алюминия с концентрированной серной кислотой
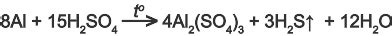
Взаимодействие алюминия с концентрированной серной кислотой является экзотермическим процессом, сопровождающимся выделением большого количества тепла. При этом происходят интенсивное выделение газа, образование соли и образование слоя оксида алюминия на поверхности алюминиевого образца. В реакции участвует алюминий в виде металла и серная кислота в концентрированной форме.
Вначале происходит диссоциация серной кислоты, образуя ионы водорода и ионы сульфата. Затем алюминий реагирует с ионами водорода, освобождая их. При этом происходит окисление алюминия до иона Аl3+, а ионы H+ вступают в реакцию с ионами SO4^2-, образуя молекулы воды и нерастворимый осадок сульфата алюминия.
Со временем на поверхности алюминиевого образца формируется тонкий слой оксида алюминия Al2O3, который защищает металл от дальнейшего воздействия серной кислоты. Однако, если поверхность алюминия нарушена, например, при шлифовке или обработке, реакция может продолжаться с образованием газов и выделением тепла.
Процесс окисления железа концентрированной серной кислотой

Окисление железа концентрированной серной кислотой происходит с образованием соответствующих продуктов. Данный процесс является реакцией окисления-восстановления, которая проходит с выделением значительного количества тепла и образованием гидрооксидов железа.
Главным продуктом данной реакции является серный диоксид (SO2), который выделяется в виде газа. При окислении железа ионами сероводорода (H2S), содержащимися в серной кислоте, образуется сернистый ангидрид (SO2) и вода (H2O).
Кроме того, окисление железа концентрированной серной кислотой приводит к образованию сульфата железа(II) (FeSO4), который является растворимой солью. Данная соль образует кристаллы и может быть использована в различных отраслях промышленности и медицине.
Таким образом, процесс окисления железа концентрированной серной кислотой – это химическая реакция, в результате которой образуются серный диоксид, вода и сульфат железа(II). Данная реакция является важным явлением в химии и имеет практическое применение в различных областях человеческой деятельности.
Реакция цинка с концентрированной серной кислотой

Реакция цинка с концентрированной серной кислотой является хорошо известной химической реакцией, протекающей с выделением водорода. Данный процесс является типичным примером реакции металла с кислотой.
В результате взаимодействия цинка (Zn) с концентрированной серной кислотой (H2SO4) образуются продукты: сульфат цинка (ZnSO4) и водород (H2). Сульфат цинка представляет собой белый кристаллический порошок, растворимый в воде.
Реакция между цинком и серной кислотой можно представить следующим уравнением:
Zn + H2SO4 → ZnSO4 + H2
Вода, образующаяся при реакции, выделяется в виде газа и приводит к появлению шипения и пузырьков. Водород, выделяющийся во время реакции, можно заметить по горению тонкой проволоки или спички, поднесенной к месту выделения газа.
Реакция цинка с концентрированной серной кислотой является экзотермическим процессом, то есть сопровождается выделением тепла. Это можно заметить по небольшому повышению температуры реакционной смеси.
Данная реакция имеет множество практических применений. Например, сульфат цинка используется в различных отраслях промышленности, включая химическую, фармацевтическую и сельское хозяйство. Водород, выделяющийся при реакции, применяется как энергетическое топливо и в процессах синтеза химических соединений.
Взаимодействие меди с концентрированной серной кислотой

Взаимодействие меди с концентрированной серной кислотой является химической реакцией, которая приводит к образованию продуктов. Эта реакция происходит с выделением газа и возможным образованием соли серной кислоты.
Медь – реактивный металл, который может взаимодействовать с кислотами, включая серную кислоту. При взаимодействии концентрированной серной кислоты с медью происходит образование двух продуктов: сернистого газа и соли серной кислоты.
Образование сернистого газа (SO2) происходит из-за окисления меди молекулами кислорода из воздуха. Отдельные атомы меди переходят из нейтрального состояния в положительное оксидное состояние, при этом начинают связываться с молекулами кислорода. Также происходит окисление ионов серы (S2–) серным газом, образующимся в результате реакции.
Помимо газообразных продуктов образуется также соль серной кислоты. Соль образуется из-за реакции ионов меди (Cu2+) c водородными ионами (H+) серной кислоты. Образованная соль имеет формулу CuSO4 и называется сульфатом меди(II).
Таким образом, взаимодействие меди с концентрированной серной кислотой приводит к образованию сернистого газа (SO2) и соли серной кислоты (CuSO4). Эта реакция является примером окислительно-восстановительной реакции, где медь подвергается окислению, а ионы серы получают электроны и восстанавливаются.
Вопрос-ответ

Какие продукты образуются при реакции концентрированной серной кислоты с металлами?
В результате реакции концентрированной серной кислоты с металлами образуются соответствующие сульфаты металлов и водород.
Как происходит реакция концентрированной серной кислоты с металлами?
Реакция концентрированной серной кислоты с металлами происходит по следующей схеме: сначала происходит образование оксида металла и водорода, затем оксид металла растворяется в кислоте, образуя сульфат металла.
Какой реагент обычно используют для реакции с металлами?
Для реакции с металлами обычно используют концентрированную серную кислоту (H2SO4).
Могут ли происходить сопутствующие реакции при взаимодействии серной кислоты с металлами?
При взаимодействии серной кислоты с металлами, помимо основной реакции образования сульфатов металлов и водорода, могут происходить сопутствующие реакции, например, окисление некоторых металлов или образование нерастворимых осадков.
