Реакция металлов с кислотами является одной из фундаментальных химических реакций. При взаимодействии металла с кислотой образуются соединения, которые называются солями. Такие реакции широко используются в промышленности и в химическом анализе. Каждый металл взаимодействует с кислотой по-своему, образуя свои характерные продукты.
Список продуктов реакции металлов с кислотами включает множество соединений. Например, алюминий при взаимодействии с соляной кислотой образует соль алюминия и выделяет водород. Медь взаимодействует с серной кислотой, образуя соль меди и выделяя сернистый газ. Стронций при реакции с фосфорной кислотой образует соль стронция и выделяет фосфористый газ.
Каждый из продуктов реакции металлов с кислотами обладает своими уникальными свойствами. Например, соль алюминия обладает кислыми свойствами и широко используется в промышленности в качестве катализатора. Соль меди обладает хорошей проводимостью электричества и используется в электротехнике. Соль стронция образует красные огнетушители и используется в пиротехнике.
Общая информация о реакциях металлов с кислотами

Реакции металлов с кислотами являются одним из основных примеров химических реакций. Эти реакции происходят между активными металлами (например, натрием, калием, магнием и цинком) и различными видами кислот, такими как соляная кислота (HCl), серная кислота (H2SO4) и азотная кислота (HNO3).
В результате таких реакций образуется соль металла и соответствующий газ, который часто можно наблюдать в виде пузырьков или запаха. Например, реакция металла с соляной кислотой приводит к образованию хлорида металла и выделению хлороводорода (HCl) в виде газа.
Данные реакции металлов с кислотами происходят благодаря тому, что металлы обладают способностью образовывать ионы в растворе кислоты. Это происходит из-за высокой активности металлов и их стремления отдать электроны при взаимодействии с кислотой. Таким образом, реакция между металлом и кислотой является реакцией окисления-восстановления, в которой металл окисляется, а кислота восстанавливается.
Эти реакции могут быть полезными при получении солей металлов и в промышленности, а также опасными из-за выделения газов, которые могут быть ядовитыми или взрывоопасными. Поэтому необходимо соблюдать меры предосторожности при работе с металлами и кислотами.
Металлы, реагирующие с кислотами
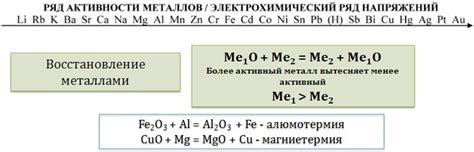
Металлы – вещества, обладающие высокой электропроводностью и способные образовывать положительно заряженные ионы – катионы. Ряд металлов способен реагировать с кислотами, образуя соли и выделяя водород.
Наиболее активные металлы, такие как натрий, калий и литий, реагируют с водой уже при комнатной температуре, образуя соответствующие гидроксиды и выделяя водородный газ. С металлами меньшей активности, к примеру, цинком или железом, реакции проходят с кислотами.
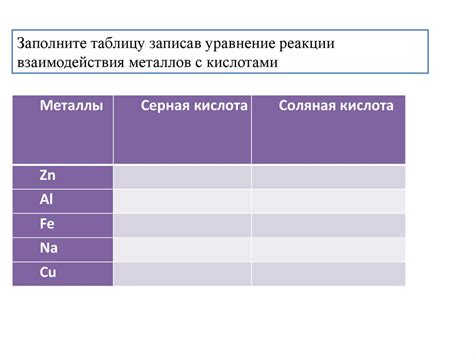
Химические реакции между металлами и кислотами могут быть представлены следующими уравнениями:
- Цинк (Zn) реагирует с хлороводородной кислотой (HCl)
Zn + 2HCl = ZnCl2 + H2 - Железо (Fe) реагирует с серной кислотой (H2SO4)
Fe + H2SO4 = FeSO4 + H2 - Медь (Cu) реагирует с азотной кислотой (HNO3)
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
Реакции металлов с кислотами сопровождаются выделением водородного газа, который можно обнаружить посредством проведения испытания на горение – воспламенение водородной смеси. Полученные соли можно растворять в воде, получая растворы, которые обладают определенными электролитическими свойствами и используются в различных областях науки и промышленности.
Процесс реакции металлов с кислотами

Реакция металлов с кислотами представляет собой химический процесс, при котором происходит образование соли и выделение водорода. Эта реакция является одним из основных методов получения солей металлов в лаборатории и промышленности.
В результате взаимодействия металлов с кислотами происходит образование соли и выделение водорода. Соли могут быть как растворимыми, так и нерастворимыми в воде. Образование нерастворимых солей может привести к образованию осадка или мутности в растворе.
Реакция металлов с кислотами подразумевает переход электронов от металла к водороду, при этом происходит окисление металла и восстановление водорода. Углеводороды, содержащиеся в кислотах, действуют как окислители, а металлы - как восстановители.
Реакция металлов с кислотами может протекать сообразно ряду их активности. Так, активные металлы, такие как натрий, калий, реагируют с кислородсодержащими кислотами, например соляной или сульфатной, уже при комнатной температуре. Но более пассивные металлы, такие как железо или медь, обычно требуют дополнительного нагревания для начала реакции.
Изучение реакции металлов с кислотами позволяет определить активность металла и его способность взаимодействовать с оксидообразующими средами. Кроме того, результаты этой реакции могут быть использованы для определения концентрации кислоты или изучения свойств металлов в различных условиях.
Физические свойства формирующихся продуктов

Продукты реакции металлов с кислотами обладают различными физическими свойствами. Одним из наиболее заметных свойств является их состояние — продукты могут быть как твердыми, так и жидкими. Например, реакция железа с соляной кислотой образует твердое вещество — хлорид железа, в то время как реакция цинка с серной кислотой образует жидкость — сульфат цинка.
Кроме того, продукты реакции металлов с кислотами могут иметь разные цвета. Например, хлорид железа имеет зеленовато-желтую окраску, а сульфат цинка имеет белый цвет. Это связано с наличием различных соединений в продуктах реакции, которые могут обладать определенными оптическими свойствами.
Также, формирующиеся продукты могут обладать разной плотностью. Например, хлорид железа имеет плотность около 3 г/см³, а сульфат цинка — около 3,5 г/см³. Это связано с различием в массе и объеме этих соединений, а также их молекулярной структурой.
Большинство продуктов реакции металлов с кислотами обладает высокой степенью растворимости в воде. Однако, некоторые продукты, такие как нитраты и хлориды некоторых металлов (например, свинца и серебра), обладают низкой растворимостью в воде. Это может иметь значительное значение при изучении свойств этих соединений и их использовании в различных сферах науки и промышленности.
Химические свойства продуктов реакции
Продукты реакции металлов с кислотами обладают определенными химическими свойствами, которые зависят от их состава и структуры. Одним из химических свойств продуктов реакции является их растворимость в воде. Некоторые продукты реакции металлов с кислотами растворяются в воде, образуя ионные растворы, которые могут проводить электрический ток. Другие продукты реакции металлов с кислотами плохо растворяются в воде и образуют нерастворимые осадки.
Еще одним химическим свойством продуктов реакции металлов с кислотами является их способность образовывать соли. В результате реакции металла с кислотой образуется соль, которая может быть ионным или молекулярным соединением. Ионная соль образуется при реакции металла с кислотой, в которой катионом является металл, а анионом - кислотный остаток. Молекулярная соль образуется при реакции металла с некоторыми кислотами, в которой металл вступает в ковалентную связь с кислотным остатком.
Также следует отметить, что продукты реакции металлов с кислотами могут обладать различными окрашивающими свойствами. Некоторые продукты реакции образуют окрашенные соединения, которые могут иметь различные оттенки в зависимости от вида металла и кислоты. Это явление связано с наличием переходных металлов в реагентах и их способностью образовывать соединения с разными степенями окисления.
Итак, химические свойства продуктов реакции металлов с кислотами включают их растворимость, способность образовывать соли и окрашивающие свойства. Эти свойства могут быть использованы в химических исследованиях, а также в промышленности и других отраслях науки и техники.
Роль металлического иона в реакции

Металлический ион играет важную роль в реакции с кислотой, так как он является активным компонентом металла. Когда металл вступает в контакт с кислотой, происходит реакция, в результате которой образуется соль. Металлический ион входит в состав этой соли и обладает уникальными свойствами.
Металлический ион может образовывать положительные ионы с разной степенью валентности в зависимости от его места в периодической таблице. Это влияет на свойства полученной соли и ее способность взаимодействовать со средой. Например, ионы некоторых металлов обладают высокой активностью и способны реагировать с кислотами даже при низкой их концентрации.
Металлический ион также может играть роль катализатора в реакции между металлом и кислотой. Катализатор ускоряет реакцию, участвуя в ней, но при этом остается неизменным и может использоваться снова. Металлический ион может участвовать в циклических реакциях, где он переходит от одного состояния к другому, способствуя обмену протонов и электронов между металлом и кислотой.
Важно отметить, что свойства металлического иона также могут влиять на окраску полученных солей. Некоторые ионы придают соли характерные цвета, что позволяет использовать их в аналитической химии для определения присутствия ионов металлов в растворе.
Реактивность металлов
Металлы проявляют различную степень реактивности при взаимодействии с кислотами. Их реактивность определяется электрохимическим потенциалом металла, который указывает на его способность вступать в реакцию окисления с водородными ионами кислот.
В таблице активности металлов приведены металлы в порядке убывания их реактивности. Верхние металлы в таблице, такие как калий, натрий и литий, реагируют со всеми кислотами и очень быстро выделяют водород. Некоторые металлы, такие как магний и цинк, реагируют только с сильными кислотами, такими как соляная или серная, образуя соли и выделяя водород.
Металлы, которые находятся ниже в таблице активности, такие как медь и серебро, реагируют только с сильными кислотами, образуя соли, но не выделяют водород. Некоторые металлы, такие как железо и алюминий, реагируют с сильными кислотами, но не реагируют с более слабыми кислотами, такими как уксусная кислота.
Реактивность металлов с кислотами может быть использована для получения солей металлов или водородных газов. Она также может быть использована для химических анализов, таких как определение содержания металла в растворе или идентификация неизвестных металлов.
Использование продуктов реакции

Продукты реакции металлов с кислотами имеют широкий спектр применений в различных сферах деятельности.
В промышленности продукты реакции используются для получения различных химических веществ. Например, некоторые металлы, такие как цинк и железо, реагируют с соляной кислотой, образуя хлориды. Хлорид цинка и хлорид железа находят широкое применение при производстве лекарств, пищевых добавок, пластмасс, ионных жидкостей и других химических продуктов.
В быту продукты реакции металлов с кислотами находят применение в качестве очистителей и дезинфицирующих средств. Например, растворы хлорида железа или алюминия, полученные при реакции металлов с соляной кислотой или серной кислотой, успешно применяются в бытовой химии для удаления ржавчины, отложений и бактерий.
Продукты реакции металлов с кислотами также используются в лабораторных исследованиях. Например, при проведении химических анализов они могут использоваться для определения содержания определенных элементов в образце.
Однако следует помнить, что металлы имеют различную активность в реакции с кислотами. Некоторые металлы, такие как золото и платина, практически не реагируют с кислотами, в то время как другие, такие как цинк и алюминий, могут реагировать даже со слабыми кислотами. Поэтому при использовании продуктов реакции необходимо учитывать их свойства и активность.
Практическое применение реакции металлов с кислотами
Реакция металлов с кислотами имеет широкое практическое применение в различных отраслях науки и техники. Например, реакция металлов с кислотами часто используется в химическом анализе. Проводя такую реакцию, можно определить наличие и концентрацию кислоты в растворе.
Также, реакция металлов с кислотами применяется в процессах очистки металлов от окисленных слоев. Реакция с кислотой позволяет эффективно удалить окисленный слой с поверхности металла и восстановить его первоначальный вид и свойства.
Применение реакции металлов с кислотами не ограничивается только химическими процессами. Она также находит применение в электротехнике и электрохимии. Например, в процессе гальванизации металлов на поверхности проводника формируется защитная пленка, которая помогает предотвратить коррозию металла.
Кроме того, реакция металлов с кислотами используется в процессе синтеза различных соединений и материалов. Например, она может служить первым этапом процесса получения солей, используемых в фармацевтической промышленности или в других сферах научно-технического прогресса.
Вопрос-ответ

Какие продукты образуются при реакции металлов с кислотами?
При реакции металлов с кислотами образуются соли и водород.
Какие свойства у образующихся солей при реакции металлов с кислотами?
Образующиеся соли при реакции металлов с кислотами могут иметь различные свойства, в зависимости от металла и кислоты. Некоторые соли могут быть растворимыми в воде, а другие - нерастворимыми.
Какие металлы реагируют с кислотами?
Самые активные металлы, такие как натрий, калий и магний, реагируют с кислотами и выделяются водород. Другие металлы, такие как железо и алюминий, также могут реагировать с кислотами, но реакция может быть менее интенсивной.
Что происходит в реакции металлов с кислотами?
При реакции металлов с кислотами ион водорода из кислоты замещается ионами металла. В результате образуются соли и выделяется водородный газ.
Какие могут быть примеры реакций металлов с кислотами?
Примеры реакций металлов с кислотами включают реакцию железа с соляной кислотой, реакцию цинка с серной кислотой и реакцию меди с азотной кислотой. В каждом случае образуется соответствующая соль и выделяется водородный газ.
